- Контакты для обращений: Открыть WhatsApp
- Пн-Сб (10:00 - 18:00)
- info@aprazer.com.ru
Софосбувир: новый пероральный препарат для лечения вирусного гепатита С, принимаемый один раз в день
Софосбувир: инструкция по применению, цена - подробная информация о препарате для лечения гепатита С.
В ходе масштабного международного исследования, проведенного в период 2019-2023 гг. с участием 2500 пациентов, была подтверждена высокая эффективность препарата Софосбувир в лечении хронического вирусного гепатита С. Исследование показало, что однократный ежедневный прием препарата в дозировке 400 мг в составе комбинированной терапии приводит к устойчивому вирусологическому ответу (УВО) у 95-98% пациентов через 12 недель после окончания лечения. Особенно важным результатом стало подтверждение эффективности препарата при различных генотипах вируса, включая наиболее распространенные генотипы 1 и 3, а также у пациентов с компенсированным циррозом печени.
Софосбувир инструкция по применению показывает, что препарат в дозировке софосбувир 400мг принимается один раз в день. Лечение софосбувиром должно проводиться под наблюдением врача.
ВВЕДЕНИЕ
Вирус гепатита С (ВГС) является серьезной проблемой общественного здравоохранения и основной причиной трансплантации печени и гепатоцеллюлярной карциномы. 1 Во всем мире около 180 миллионов человек инфицированы ВГС; распространенность инфекции ВГС в США составляет 1,6%, что соответствует примерно 4,1 миллиона инфицированных человек. 2 Однако более поздние данные наблюдения свидетельствуют о том, что инфицирование ВГС возросло до 5,2 миллионов человек в США. 3 Существует шесть генотипов ВГС, при этом различные подтипы генотипа 1 являются наиболее распространенными в Америке и Европе.
Передача вируса гепатита С происходит через контакт с инфицированной кровью. Группа населения, подверженная наибольшему риску передачи вируса гепатита С, — это потребители внутривенных наркотиков. Другими факторами риска являются получение продуктов крови и/или трансплантация органов до инициативы скрининга крови в 1992 году, уколы иглой, множественные половые партнеры, рождение от матери, инфицированной вирусом гепатита С, пирсинг или татуировки, а также гемодиализ. Более высокие показатели инфицирования вирусом гепатита С отмечаются у заключенных и бездомных. Вирус покрывается липопротеинами низкой плотности, чтобы проникнуть в гепатоцит. Трансляция одноцепочечной РНК в полипротеин происходит в гепатоците. Различные ферменты расщепляют вирусный полипротеин, позволяя собрать репликационный комплекс и происходит репликация вируса. Жизненный цикл вируса полностью происходит в гепатоците и не включает интеграцию в геном хозяина; вот почему инфекцию гепатита С можно искоренить, в отличие от других хронических вирусных инфекций.
Из тех, у кого острая инфекция HCV, у 20% будет спонтанное выздоровление и избавление от вируса без лекарств. У остальных 80% сохранится хроническая инфекция HCV, которая является медленно прогрессирующим заболеванием. Повреждение печени связано с клеточно-опосредованным воспалением, а быстрое разрушение и обновление клеток может привести к развитию гепатоцеллюлярной карциномы. Тридцать процентов хронических инфекций HCV приведут к циррозу печени, а 25% людей с циррозом в конечном итоге умрут от печеночной недостаточности или рака печени, если им не сделают пересадку печени.
С момента одобрения в 1991 году интерферон стал основой лечения пациентов, инфицированных вирусом гепатита С, обеспечивая устойчивый вирусологический ответ (УВО) у 15–25 % пациентов с инфекцией генотипа 1 при назначении в качестве монотерапии. 4 Использование интерферона альфа в сочетании с рибавирином почти удвоило показатели ответа при инфекции генотипа 1, тогда как у пациентов с генотипом 2 или 3 показатели УВО составляли от 70 % до 85 %. 5 Более десятилетия не существовало других классов лекарств для усиления лечения генотипа 1, но в 2011 году ингибиторы протеазы NS3/4A боцепревир (Victrelis, Merck) и телапревир (Incivek, Vertex) стали доступны для лечения пациентов с инфекцией генотипа 1.
Комбинация ингибитора протеазы с пегилированным интерфероном альфа-2а (Pegasys, Roche) и рибавирином обеспечила показатели УВО от 68% до 75% у пациентов с генотипом 1, ранее не получавших лечения. 6 , 7 Однако этот режим имел существенные ограничения из-за противопоказаний и непереносимости терапии интерфероном, дополнительных побочных эффектов анемии от рибавирина, низкого генетического барьера для развития резистентности, присущей ингибиторам протеазы, и частых интервалов дозирования. 8 , 9 В настоящее время изучаются несколько мощных противовирусных препаратов прямого действия (ПППД) для удовлетворения потребности в безинтерфероновой полностью пероральной терапии.
Софосбувир (Sovaldi, Gilead Sciences) — нуклеотидный аналог ингибитора полимеразы NS5B, одобренный Управлением по контролю за продуктами и лекарствами 6 декабря 2013 года для лечения хронической инфекции ВГС в качестве компонента комбинированной схемы противовирусной терапии. 10 В этой статье рассматриваются фармакология, фармакодинамика, фармакокинетика, профиль резистентности, клиническая эффективность, данные по безопасности и современная роль этого средства в терапии.
Дополнительная информация:
Софосбувир применениеФАРМАКОЛОГИЯ
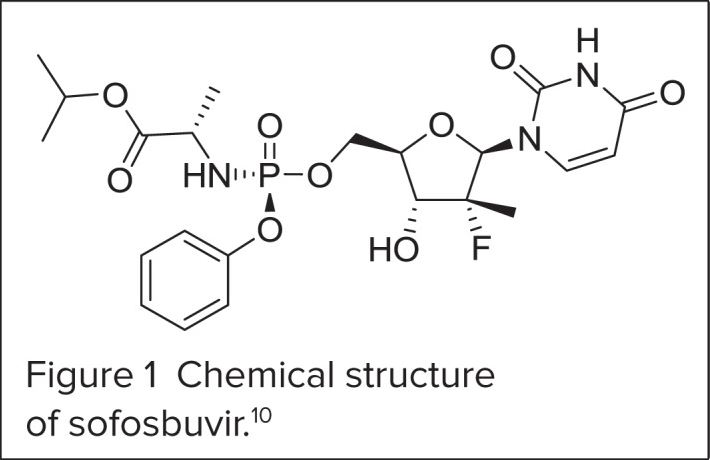
Софосбувир инструкция описывает механизм действия препарата, как ( S )-изопропил 2-((S)-(((2 R ,3 R ,4 R ,5 R )-5-(2,4-диоксо-3,4-дигидропиримидин-1(2 H )-ил)-4-фтор-3-гидрокси-4-метилтетрагидрофуран-2-ил)метокси)-(фенокси) фосфориламино)пропаноат. 10 На рисунке 1 показана химическая структура софосбувира. Аналог уридиннуклеотида, он оказывает противовирусное действие путем ингибирования фермента РНК-полимеразы NS5B. Для репликации HCV требуется NS5B, РНК-зависимая РНК-полимераза, которая отвечает за синтез как положительной цепи геномной РНК, так и отрицательной цепи РНК. 12 Софосбувир имитирует естественный субстрат полимеразы NS5B и включается в растущую РНК, вызывая событие обрыва цепи.
Дополнительная информация:
Софосбувир инструкция ценаФАРМАКОКИНЕТИКА
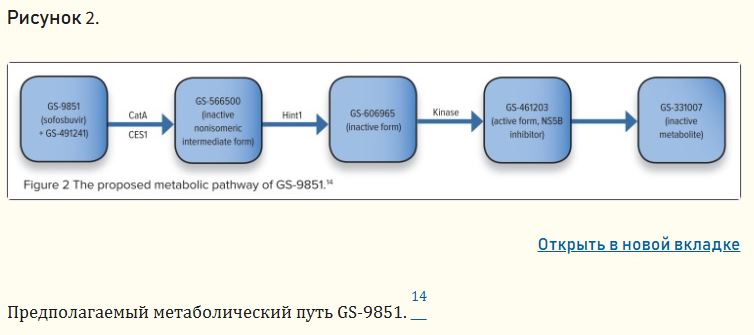
Первоначально GS-9851, смесь двух диастереоизомеров — софосбувира (GS-7977) и GS-491241 — был обнаружен как агент с высокой эффективностью и селективностью для ингибирования NS5B. Фармакокинетические и фармакодинамические параметры были оценены для GS-9851; однако после разработки метода разделения изомеров софосбувир был выбран для дальнейшей разработки как более активный ингибитор РНК-полимеразы. Поскольку оба изомера GS-9851 разделяют один и тот же метаболический путь, 14 результаты можно применить к софосбувиру.
Исследование in vitro предполагает, что GS-9851 является пролекарством, которое преобразуется в неактивную, неизомерную промежуточную форму с помощью двух ферментов: катепсина A (CatA) и карбоксилэстеразы 1 (CES1). Кроме того, нуклеотидсвязывающий белок гистидиновой триады 1 (Hint1) гидролизует соединение в неактивную монофосфатную форму, которая затем метаболизируется ферментами киназы в активную форму (GS-461203), которая ингибирует РНК-полимеразу NS5B. 14 В результате этого специфического метаболизма софосбувир имеет низкий потенциал для взаимодействия между лекарственными средствами, опосредованного цитохромом P450. Предполагаемый метаболический путь GS-9851 изображен на рисунке 2. Краткое изложение фармакокинетики софосбувира и последующих метаболитов представлено в таблице 1 . 15 Основным путем выведения софосбувира является почечный клиренс, что может представлять проблему для людей с почечной недостаточностью.
| Параметр | Софосбувир |
|---|---|
| Поглощение | Пик концентрации в плазме наблюдается через 0,5–2 часа после приема дозы. |
| Влияние пищи | Не влияет на эффективность препарата |
| Метаболизм | Гидролиз, фосфорилирование, дефосфорилирование |
| Устранение | Выведение почками (80% активного метаболита выводится с мочой) |
| Распределение | 61–65% связывается с белками плазмы человека |
Дополнительная информация:
Софосбувир отзывыПРОФИЛЬ СОПРОТИВЛЕНИЯ
Ингибиторы РНК-полимеразы NS5B можно разделить на две группы: ингибиторы аналогов нуклеоз(т)идов, включая софосбувир, и ненуклеозидные ингибиторы. Ингибиторы полимеразы NS5B на основе аналогов нуклеоз(т)идов, как класс, имеют высокий генетический барьер к резистентности. Они нацелены на активный центр NS5B, который является высококонсервативной областью вирусного генома, и изменение аминокислотной последовательности может привести либо к потере функции полимеразы NS5B, либо к значительному снижению репликативной приспособленности вируса.16 Исследование in vitro показало, что только изменение аминокислоты S282T снижает ингибирующую активность софосбувира.17 Софосбувир , как один из ингибиторов аналогов нуклеоз(т)идов, имеет отчетливый профиль резистентности, который не перекрывается с ненуклеозидными ингибиторами протеазы NS5B, что делает софосбувир привлекательным игроком команды для потенциальных комбинаций лечения.18
Данные по резистентности in vivo очень ограничены. Только у одного пациента был обнаружен вариант S282T после окончания лечения софосбувиром, что указывает на то, что резистентность к софосбувиру встречается крайне редко. 18 Кроме того, клинические испытания 19 , 20 продемонстрировали высокие показатели УВО у 90% пациентов, а у немногих пациентов с вирусологическими неудачами резистентный вирус не появлялся, что создает высокий генетический барьер для резистентности к софосбувиру.
Дополнительная информация:
Софосбувир аптекаОСНОВНЫЕ КЛИНИЧЕСКИЕ ИСПЫТАНИЯ
Пациенты, ранее не проходившие лечение
Испытание FISSION
Лавиц и соавторы провели рандомизированное открытое исследование фазы 3 с активным контролем, чтобы сравнить эффективность и безопасность софосбувира (СОФ) плюс рибавирин (РБВ) с пегинтерфероном альфа-2а (ПЭГ) плюс РБВ у пациентов с генотипом 2 или 3, которые ранее не получали лечения от инфекции ВГС.
В общей сложности 499 пациентов (средний возраст 48 лет) с генотипом 2 или 3 инфекции получали либо SOF 400 мг перорально один раз в день плюс RBV перорально 1000 мг/день или 1200 мг/день в разделенных дозах у пациентов с массой тела менее 75 кг или не менее 75 кг соответственно в течение 12 недель, либо предыдущий стандарт лечения, ПЭГ 180 мкг подкожная инъекция (SC) один раз в неделю плюс RBV 800 мг перорально ежедневно в двух разделенных дозах в течение 24 недель. Обратите внимание на более высокую дозу RBV, используемую в группе SOF. Первичной конечной точкой эффективности был устойчивый вирусологический ответ, определяемый как уровень РНК HCV ниже нижнего предела количественной оценки через 12 недель после окончания лечения (SVR12).
Что касается первичной конечной точки, исследование FISSION продемонстрировало не меньшую эффективность схемы SOF+RBV по сравнению с PEG+RBV. Обе группы, SOF+RBV и PEG+RBV, продемонстрировали одинаковый уровень УВО в 67%; однако результаты значительно различались между генотипами. В группе SOF+RBV УВО наблюдался у 97% пациентов с генотипом 2 инфекции и только у 56% пациентов с генотипом 3. Большинство пациентов, включенных в FISSION, были инфицированы генотипом 3 (более 70%), что может объяснять, почему общие показатели УВО в группе SOF+RBV составили 67%. Таким образом, важно учитывать, что комбинация СОФ+РБВ демонстрирует впечатляющие показатели УВО, особенно у пациентов с генотипом 2. Примечательно, что только у одного пациента, принимавшего СОФ+РБВ, наблюдался вирусный прорыв с неопределяемыми уровнями СОФ в плазме (предположительно из-за несоблюдения режима лечения), по сравнению с 18 случаями в группе ПЭГ+РБВ.
Авторы пришли к выводу, что схема SOF+RBV не уступает схеме PEG+RBV с аналогичным показателем УВО 67% у ранее не леченных пациентов с инфекцией генотипа 2 или 3. Однако важно отметить, что показатели ответа на SOF+RBV были намного выше у пациентов с генотипом 2, чем у пациентов с генотипом 3 в той же группе лечения.
Испытание NEUTRINO 19
Lawitz et al. провели еще одно одногрупповое открытое исследование фазы 3 для оценки эффективности и безопасности SOF+RBV+PEG у ранее не леченных пациентов, инфицированных генотипом HCV 1, 4, 5 или 6. Генотип 1 является причиной большинства инфекций HCV в США и исторически его было сложнее лечить по сравнению с генотипом 2 или 3. Генотипы 4, 5 и 6 не распространены в США, и успехи в лечении были в значительной степени недостаточными. Среди пациентов, включенных в исследование, 89% имели генотип HCV 1, 9% имели генотип 4 и 2% имели генотип 5 или 6, что соответствует распространенности генотипов HCV в США.
В общей сложности 327 пациентов получили тройную терапию с SOF 400 мг перорально один раз в день плюс RBV и PEG в течение 12 недель лечения. Первичной конечной точкой эффективности был SVR12. Исследование NEUTRINO продемонстрировало частоту SVR 90%. Не было никаких существенных различий в частоте SVR среди групп с разным генотипом инфекции: 92% для пациентов с генотипом 1a, 82% для генотипа 1b и 96% для генотипа 4. Все семь пациентов с генотипами 5 и 6 имели SVR в этом исследовании. Пациенты без цирроза на исходном уровне достигли SVR в 92% случаев по сравнению с 80% пациентов, у которых был цирроз на момент начала лечения. Авторы пришли к выводу, что у пациентов с генотипом 1 или 4 ВГС, ранее не получавших лечения, схема лечения СОФ+РБВ+ПЭГ в течение 12 недель показала высокую эффективность и заметное снижение побочных эффектов по сравнению с текущим стандартом лечения.
Пациенты без возможности лечения или пациенты, прошедшие лечение
Испытание POSITRON 20
POSITRON, слепое плацебо-контролируемое исследование, было проведено для оценки эффективности и безопасности лечения SOF+RBV у пациентов с генотипом HCV 2 или 3, у которых были противопоказания к терапии интерфероном, которые ранее прекратили терапию интерфероном из-за побочных эффектов или которые решили отказаться от терапии интерфероном по разным причинам. Среди пациентов, включенных в исследование, 51% имели инфекцию генотипа HCV 2, а 49% — генотипа 3.
Всего 278 пациентов с генотипом 2 или 3 были рандомизированы для получения либо SOF 400 мг перорально один раз в день плюс RBV перорально 1000 мг/день или 1200 мг/день, разделенных на две дозы у пациентов, которые весили менее 75 кг или не менее 75 кг соответственно (n = 207), либо соответствующего плацебо (n = 71) в течение 12 недель. Первичной конечной точкой эффективности был УВО12.
Исследование POSITRON продемонстрировало уровень УВО 78% в группе SOF+RBV по сравнению с 0% пациентов, получавших плацебо ( P < 0,001). Ни у одного из 153 пациентов, подлежащих оценке, не было вирусологического рецидива после 12-й недели. Подобно FISSION, в группе лечения УВО наблюдался у 93% пациентов с инфекцией генотипа 2 ВГС по сравнению с 61% пациентов с генотипом 3. Результаты показывают, что 12 недель лечения SOF+RBV являются эффективным вариантом лечения у пациентов с инфекцией генотипа 2 ВГС, для которых лечение пегинтерфероном не является вариантом.
Испытание FUSION 20
FUSION, слепое исследование с активным контролем, было проведено для оценки эффективности и безопасности SOF+RBV у пациентов с инфекцией вируса гепатита С генотипа 2 или 3, у которых предыдущее лечение оказалось неэффективным: они не отреагировали на схему лечения, содержащую интерферон (25% включенных в исследование пациентов), или у них произошел рецидив (75%).
Чтобы определить, повлияет ли более длительная продолжительность лечения на УВО, 201 пациент получал либо SOF+RBV в течение 12 недель с последующими четырьмя неделями плацебо, либо полные 16 недель SOF+RBV. Среди пациентов, включенных в исследование, у 34% была инфекция генотипа 2 вируса гепатита С, а у 63% — генотипа 3 (у шести пациентов после рандомизации был обнаружен генотип 1, и они были исключены из анализа эффективности).
p>Пациенты достигли УВО в 50% случаев в 12-недельной группе по сравнению с 73% в 16-недельной группе (разница, −23%, P < 0,001). Показатели УВО у пациентов без цирроза были значительно выше, чем у пациентов с циррозом, как и ожидалось. Однако у пациентов с генотипом 2 не было никакой разницы между 12 и 16 неделями лечения, в то время как у пациентов с генотипом 3 наблюдался значительно более высокий показатель УВО при лечении в течение 16 недель. Частота рецидивов составила 46% среди пациентов в 12-недельной группе по сравнению с 27% в 16-недельной группе. Авторы пришли к выводу, что 12 или 16 недель лечения по схеме SOF+RBV были эффективными. Лечение имело более высокую эффективность у пациентов с инфекциями генотипа 2 HCV и у пациентов без цирроза. При дальнейшем увеличении продолжительности лечения SOF+RBV до 24 недель при генотипе 3 вирусного гепатита С показатели УВО возросли до сопоставимых 84%, как показано в исследовании VALENCE. 21Сводка результатов эффективности и безопасности этих четырех основных клинических испытаний представлена в Таблице 2 .
| Параметр | FISSION | NEUTRINO | POSITRON | FUSION | |||||
|---|---|---|---|---|---|---|---|---|---|
| Исследование | Рандомизированное, открытое, активный контроль | Одногрупповое, открытое | Слепое, плацебо-контролируемое | Слепое, активный контроль | |||||
| Количество пациентов | 499 | 327 | 278 | 201 | |||||
| Популяция | Пациенты, ранее не получавшие лечения | Пациенты с ВГС генотипа 2 или 3 без вариантов лечения | |||||||
| ВГС генотип 2 или 3 | ВГС генотип 1, 4, 5 или 6 | Пег-интерферон противопоказан | Не ответили на предыдущую терапию интерфероном | ||||||
| Группа лечения | SOF+RBV 12 недель (n = 256) | PEG+RBV 24 недели (n = 243) | SOF+RBV+PEG 12 недель (N = 327) | SOF+RBV 12 недель (n = 207) | Плацебо 12 недель (n = 71) | SOF+RBV 12 недель (n = 100) | SOF+RBV 16 недель (n = 95) | ||
| УВО, % | 67 | 67 | 90 | 78 | 0 | 50 | 73 | ||
| УВО по генотипу, % | 1 | 89.4 | |||||||
| 2 | 97.1 | 77.6 | 92.7 | 0 | 86.1 | 93.8 | |||
| 3 | 55.7 | 62.5 | 61.2 | 0 | 29.7 | 61.9 | |||
| 4, 5, 6 | 97.1 | ||||||||
| УВО при циррозе, % | Нет | 72.1 | 74.1 | 92.3 | 80.7 | 0 | 60.9 | 76.2 | |
| Да | 46.9 | 38.0 | 79.6 | 61.3 | 0 | 30.6 | 65.6 | ||
| Вирусологический прорыв | 1 | 18 | 0 | 0 | — | 0 | 0 | ||
| Рецидив у завершивших лечение, % | 29 | 20 | 8 | 20 | — | 46 | 27 | ||
| Анемия, % | 7.8 | 11.5 | 20.8 | 13.0 | 0 | 10.7 | 4.1 | ||
| Нейтропения, % | 0 | 12.3 | 16.5 | 0 | 0 | 0 | 0 | ||
| Депрессия, % | 5.5 | 14.0 | 9.5 | 7.2 | 1.4 | 5.8 | 6.1 | ||
| Гриппоподобный синдром, % | 2.7 | 18.1 | 15.6 | 3.9 | 2.8 | 1.0 | 3.1 | ||
| Утомляемость, % | 36 | 55 | 59 | 44 | 24 | 45 | 47 | ||
| Бессонница, % | 12 | 29 | 25 | 19 | 4 | 20 | 29 | ||
ВГС = вирус гепатита С; PEG = пегинтерферон; RBV = рибавирин; SOF = софосбувир; УВО = устойчивый вирусологический ответ
Дополнительная информация:
Препарат софосбувирПОБОЧНЫЕ ЭФФЕКТЫ
Согласно отзывам о софосбувире, препарат хорошо переносится большинством пациентов. Не было зарегистрировано серьезных побочных эффектов, связанных с СОФ. С приемом СОФ было связано несколько умеренных или тяжелых побочных эффектов, отклонений лабораторных показателей 3 или 4 степени или прекращений лечения. Кроме того, исследователи сообщили о гораздо более низких показателях побочных эффектов, которые можно отнести к приему СОФ, по сравнению с ПЭГ или RBV.
Поскольку SOF всегда использовался в сочетании с другими противовирусными препаратами, побочные эффекты одного SOF трудно определить. Тем не менее, частота побочных эффектов, связанных с препаратом, была ниже в группе SOF+RBV по сравнению с пациентами, получавшими схему PEG+RBV в исследовании FISSION. Почти все распространенные побочные эффекты были по крайней мере на 10% ниже в группе SOF+RBV, за исключением анемии, которая может быть связана с RBV. Наиболее очевидная разница наблюдалась в гриппоподобных симптомах и депрессии, что неудивительно, поскольку они ограничивают побочные эффекты PEG.
В исследовании NEUTRINO наиболее распространенными побочными эффектами были усталость, головная боль, тошнота, бессонница и анемия, все из которых соответствуют и сопоставимы с терапией PEG+RBV из других клинических испытаний, что позволяет предположить, что SOF не ухудшает эти побочные эффекты. Фактически, побочные эффекты привели к прекращению лечения только у 2% пациентов. Как в исследованиях POSITRON, так и в исследованиях FUSION наиболее распространенными наблюдаемыми побочными эффектами в группах лечения были усталость, тошнота, головная боль и бессонница. Хотя до 13% этих пациентов страдали анемией, невозможно определить, можно ли ее отнести к SOF, учитывая, что RBV, как известно, вызывает гемолитическую анемию. Дополнительные сведения о безопасности см. в таблице 3 .
| Терапия | SOF 12 недель |
SOF+RBV 8-12 недель |
SOF+RBV 24 недели |
SOF+PEG/RBV 8-12 недель |
SOF+PEG/RBV 24 недели |
SOF+LDV+RBV 24 недели |
|---|---|---|---|---|---|---|
| Количество пациентов | 10 | 130 | 157 | 164 | 280 | 34 |
| Нежелательные явления ≥3 степени | 0 | 2 (2%) | 12 (8%) | 27 (16%) | 44 (16%) | 3 (9%) |
| Нежелательные явления ≥2 степени | 4 (40%) | 43 (33%) | 67 (43%) | 116 (71%) | 199 (71%) | 14 (41%) |
| Серьезные нежелательные явления | 0 | 4 (3%) | 6 (4%) | 6 (4%) | 10 (4%) | 2 (6%) |
| НЯ, ведущие к прекращению терапии | 0 | 1 (<1%) | 2 (<1%) | 7 (4%) | 27 (10%) | 2 (6%) |
| Анемия | 0 | 2 (2%) | 4 (3%) | 16 (10%) | 33 (12%) | 2 (6%) |
| Нейтропения | 0 | 0 | 0 | 21 (13%) | 34 (12%) | 0 |
| Тошнота | 0 | 1 (<1%) | 5 (3%) | 13 (8%) | 18 (6%) | 0 |
| Диарея | 0 | 1 (<1%) | 7 (4%) | 2 (1%) | 11 (4%) | 0 |
| Утомляемость | 1 (10%) | 5 (4%) | 17 (11%) | 23 (14%) | 35 (13%) | 0 |
| Головная боль | 0 | 6 (5%) | 9 (6%) | 13 (8%) | 29 (10%) | 1 (3%) |
| Артралгия | 0 | 2 (2%) | 1 (<1%) | 10 (6%) | 14 (5%) | 0 |
| Тревожность | 0 | 3 (2%) | 8 (5%) | 8 (5%) | 15 (5%) | 0 |
| Бессонница | 0 | 1 (<1%) | 10 (6%) | 17 (10%) | 23 (8%) | 1 (3%) |
| Депрессия | 0 | 1 (<1%) | 8 (5%) | 9 (6%) | 14 (5%) | 2 (6%) |
| Одышка | 0 | 0 | 8 (5%) | 6 (4%) | 12 (4%) | 0 |
НЯ = нежелательное явление; LDV = ледипасвир; PEG = пегинтерферон; RBV = рибавирин; SOF = софосбувир
ОСОБЫЕ ГРУППЫ НАСЕЛЕНИЯ
Коинфекция ВИЧ/ВГС
Софосбувир и рибавирин в течение 12 или 24 недель изучались у пациентов с коинфекцией ВИЧ/ВГС с генотипами 1, 2 или 3. 23 Хотя показатели УВО генотипов 2 и 3 были впечатляющими 88% и 92%, показатель УВО генотипа 1 составил 76% без присутствия третьего противовирусного препарата. Профиль безопасности был аналогичен моноинфицированным пациентам в исследованиях фазы 3, упомянутых ранее. Благодаря этим результатам исследования PHOTON-1, софосбувир является первым препаратом прямого действия, имеющим одобренное FDA показание для лечения коинфекции ВИЧ/ВГС. 10
Гепатоцеллюлярная карцинома ожидает трансплантации печени
Пациентам с гепатоцеллюлярной карциномой (ГЦК) независимо от генотипа, которые соответствовали критериям MILAN (определяемым как наличие опухоли диаметром не более 5 см и не более трех опухолей диаметром 3 см или менее каждая), давали СОФ+РБВ в течение 24–48 недель или до трансплантации печени. 24 Из пациентов, у которых ГЦК не определялась на момент трансплантации, 64% (23 из 36) поддерживали посттрансплантационную вирусологическую супрессию. Профиль безопасности СОФ+РБВ был сопоставим с моноинфицированными пациентами в исследованиях фазы 3. Впоследствии софосбувир стал первым препаратом прямого действия, имеющим одобренное FDA показание для лечения пациентов с ГЦК, ожидающих трансплантацию печени в течение 48 недель или до трансплантации печени. 10
Почечная недостаточность
Нет рекомендаций по дозировке софосбувира для пациентов с предполагаемым клиренсом креатинина ниже 30 мл/мин или терминальной стадией почечной недостаточности, требующей гемодиализа. Безопасность и эффективность не установлены, и до тех пор, пока не будут получены результаты текущих исследований, софосбувир не следует рекомендовать пациентам с несколькими нарушениями функции почек.
Комбинации с другими новыми противовирусными средствами прямого действия
Краткое описание вариантов лечения без интерферона представлено в таблице 4 .
| Исследование | Исследования ION | COSMOS, Когорта 1 и 2 | Исследование SOF+DCV | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Схема лечения | ION-1 SOF/LDV ± RBV | ION-2 SOF/LDV ± RBV | ION-3 SOF/LDV ± RBV | Когорта 1 SOF+ SMV + RBV | Когорта 1 SOF+ SMV | Когорта 2 SOF+ SMV + RBV | Когорта 2 SOF + SMV | SOF + DCV | SOF+ DCV+ RBV |
| Количество пациентов | 431 | 440 | 647 | 51 | 29 | 57 | 30 | 21 | 20 |
| Длительность лечения, недель | 12 | 12 или 24 | 8 или 12 | 12 или 24 | 12 или 24 | 12 или 24 | 12 или 24 | 24 | 24 |
| УВО12 | 97%–98% | 94%–99% | 93%–95% | 79%–96% | 93%–94% | 93% | 93%–100% | 100% | 95% |
| Прорыв | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| Рецидив | — | — | 1 | 1 | 1 | 2 | 1 | 0 | 0 |
| Серьезные НЯ | 0 | 0 | 0 | 0 | 0 | 3 | 1 | 0 | 1 (5%) |
| НЯ, приведшие к прекращению лечения | 0 | 0 | 0 | 1 | 1 | 0 | 1 | 0 | 0 |
НЯ = нежелательное явление; DCV = даклатасвир; LDV = ледипасвир; RBV = рибавирин; SMV = симепревир; SOF = софосбувир; УВО = устойчивый вирусологический ответ
Испытание COSMOS
COSMOS, рандомизированное открытое исследование фазы 2a, было проведено для оценки эффективности и безопасности 12 или 24 недель приема SOF плюс симепревир (Olysio, Janssen Pharmaceuticals). Симепревир (SMV) — ингибитор протеазы NS3/4A, одобренный FDA в ноябре 2013 года. SOF и SMV назначались с RBV или без него пациентам с генотипом 1 вируса гепатита С, у которых не наблюдался ответ на предшествующую терапию ПЭГ. Пациенты были включены в две когорты на основе степени воспаления и фиброза печени, количественно оцененной по шкале METAVIR (F0–F2 и F3–F4).
Результаты для когорты 1 продемонстрировали УВО 96% и 93% в 12-недельных группах SOF+SMV+RBV и SOF+SMV соответственно. Никаких вирусных прорывов во время лечения не наблюдалось. Рецидив вируса после окончания лечения произошел у двух пациентов (оба в течение первых четырех недель наблюдения), по одному пациенту в каждой из 12-недельных групп. Не было выявлено резистентности к SOF и один случай возникшей резистентности к SMV. Результаты для когорты 2 продемонстрировали неопределяемую вирусную нагрузку на 12-й неделе после завершения лечения в 93% групп SOF+SMV+RBV и от 93% до 100% групп SOF+SMV. Три вирусных рецидива наблюдались через восемь недель после окончания лечения. Никаких вирусных прорывов не было зарегистрировано.
Исследователи пришли к выводу, что SOF плюс SMV с RBV или без него в течение 12 недель обеспечивали высокие показатели SVR у пациентов с нулевым ответом на терапию с генотипом 1 ВГС. Самые последние рекомендации по лечению гепатита С, написанные в феврале 2014 года, включали обнадеживающие результаты исследования COSMOS, чтобы оправдать полностью пероральный режим в качестве терапии первой линии у пациентов, которым не показан пегинтерферон или у которых в прошлом лечение было неудачным. 27
Исследование Софосбувира/Даклатасвира
Было проведено рандомизированное открытое исследование фазы 2a в параллельных группах для оценки эффективности и безопасности СОФ плюс даклатасвир (DCV, ингибитор NS5A) с рибавирином или без него в течение 24 недель у пациентов с хроническим генотипом 1 вирусного гепатита С, у которых предыдущее лечение телапревиром или боцепревиром плюс ПЭГ+рибавирином оказалось неэффективным.
В этом исследовании 41 пациент без цирроза с баллом METAVIR 2 или более, генотипом 1 ВГС и предыдущим прорывом, рецидивом или отсутствием ответа на традиционный стандарт лечения ВГС получал SOF 400 мг перорально ежедневно плюс DCV 60 мг перорально ежедневно либо с RBV, либо без него в течение 24 недель. УВО12 был достигнут у 95% (один пациент был недоступен на 12-й неделе после лечения, но имел неопределяемый ВГС на 24-й неделе лечения) и у 100% пациентов, лечившихся с RBV и без него соответственно. Прорывов или рецидивов не наблюдалось. Оба режима лечения переносились очень хорошо.
Авторы сообщили, что полностью пероральная комбинация SOF и DCV, принимаемая один раз в день с RBV или без него, позволила достичь УВО у всех пациентов, инфицированных вирусом гепатита С генотипа 1, у которых предыдущий золотой стандарт тройной терапии с ингибитором протеазы NS3/4A, ПЭГ и RBV оказался неэффективным.
Исследования ION
Результаты трех исследований фазы 3, объявленных в декабре 2013 года, оценивали комбинацию фиксированной дозы софосбувира и ингибитора NS5A ледипасвира (LDV) для приема один раз в день. ION-1 изучал комбинацию фиксированной дозы SOF/LDV с RBV или без него в течение 12 недель у пациентов с генотипом 1, ранее не получавших лечения. ION-2 изучал SOF/LDV с RBV или без него в течение 12 или 24 недель у пациентов с генотипом 1, ранее получавших лечение. А ION-3 изучал SOF/LDV с RBV или без него в течение восьми или 12 недель у пациентов с генотипом 1, ранее не получавших лечения.
Показатели УВО у 1518 пациентов во всех трех исследованиях были выше 93%. Результаты были значимыми, демонстрируя три основных момента: 1) Добавление RBV к SOF/LDV не дало никаких клинических преимуществ; 2) SOF/LDV в течение 12 недель приводило к высоким показателям УВО, даже у пациентов, ранее проходивших лечение; и 3) пациентам с генотипом 1 без цирроза, ранее не проходившим лечение, может потребоваться всего восемь недель лечения.
Компания Gilead Sciences (разработчик обоих препаратов) подала на утверждение в FDA комбинацию фиксированной дозы SOF/LDV в первом квартале 2014 года. После одобрения это будет первая схема лечения вирусом гепатита С генотипа 1 с использованием одной таблетки, что существенно отличается от прошлых стандартов лечения.
ВЗАИМОДЕЙСТВИЕ ПРЕПАРАТОВ
Клинически значимые лекарственные взаимодействия минимальны при применении софосбувира. 10 SOF является субстратом переносчика P-гликопротеина (P-gp), и мощные индукторы могут снижать концентрацию SOF в плазме, что может привести к неэффективности лечения. Однако сам SOF не влияет на концентрацию субстратов P-gp. Классы лекарств, которые являются мощными индукторами P-gp и которых следует избегать, включают: противосудорожные препараты, рифамицины и типранавир, а также траву зверобоя. За исключением типранавира, лекарственные взаимодействия не ожидаются с антиретровирусными препаратами для лечения ВИЧ, что является большим преимуществом для использования у пациентов с коинфекцией.
ДОЗИРОВКА И СПОСОБ ПРИМЕНЕНИЯ
Софосбувир — это таблетка 400 мг, которую следует принимать один раз в день с едой или без нее в течение 12 недель. Препарат одобрен для лечения генотипов HCV 1, 2, 3 или 4 в составе комбинированной схемы лечения.
Применение софосбувира возможно в различных комбинациях. Софосбувир и даклатасвир показывают высокую эффективность при генотипе 1. Софосбувир и велпатасвир эффективны при всех генотипах вируса.
Софосбувир был недавно установлен как часть каждой предпочтительной схемы в рекомендациях 2014 года по лечению гепатита С. 27 У пациентов генотипа 1, ранее не получавших лечение, или у пациентов с рецидивом, которым подходит ПЭГ, рекомендуемая схема — СОФ+ПЭГ+РБВ в течение 12 недель. Для пациентов, которые считаются не подходящими для ПЭГ, рекомендуемая схема — СОФ+СМВ±РБВ в течение 12 недель. У пациентов, у которых в прошлом ПЭГ+РБВ не дал результата, рекомендуемая схема — СОФ+СМВ±РБВ в течение 12 недель.
Пациенты с коинфекцией ВИЧ имеют те же рекомендуемые схемы с дополнительной опцией для пациентов, не имеющих права на лечение ПЭГ, но не получавших лечение: SOF+RBV в течение 24 недель. Рекомендуемая схема лечения для пациентов с генотипом 2 — SOF+RBV в течение 12 недель, независимо от истории лечения. Лечение SOF+RBV также рекомендуется для всех пациентов с генотипом 3, но в течение более длительного периода — 24 недели.
СТОИМОСТЬ СОФОСБУВИРА
Софосбувир цена в аптеке зависит от курса лечения и комбинации препаратов. Где купить софосбувир - важный вопрос для пациентов, так как необходимо приобретать препарат только у проверенных поставщиков. Оптовая стоимость закупки 28-дневного запаса софосбувира составляет 28 000 долларов США. При цене 1000 долларов США за таблетку эта стоимость вызвала обоснованные опасения относительно обоснованности курса лечения с помощью SOF. Учитывая, что большинство пациентов, инфицированных вирусом гепатита С, ждали полностью пероральных схем без ПЭГ, сторонние плательщики будут получать все больше запросов на схему SOF+SMV, а не SOF+PEG+RBV. Стоимость и ожидаемые показатели УВО текущего и прошлых видов лечения представлены в таблице 5 .
| Препарат | Дозировка | 12 недель | 24 недели | 44 недели | 48 недель |
|---|---|---|---|---|---|
| Пегинтерферон альфа-2а | 180 мкг подкожно один раз в неделю | $6,000 | $12,000 | — | $24,000 |
| Рибавирин | 1,200 мг ежедневно | $3,000 | $6,000 | — | $12,000 |
| Телапревир | 1,125 мг два раза в день | $66,155 | — | — | — |
| Боцепревир | 800 мг три раза в день | — | $40,120 | $73,554 | — |
| Симепревир | 150 мг один раз в день | $66,360 | — | — | — |
| Софосбувир | 400 мг один раз в день | $84,000 | $168,000 | — | — |
| Схема лечения | Стоимость курса | Эффективность (УВО) |
|---|---|---|
| Софосбувир + пегинтерферон + рибавирин, 12 недель | $93,000 | 90% |
| Софосбувир + симепревир, 12 недель | $150,360 | >93% |
| Софосбувир + рибавирин, 24 недели | $174,000 | 76% (генотип 1) 84% (генотип 3) |
| Софосбувир + рибавирин, 12 недель | $87,000 | >92% |
| Жизнь с компенсированным циррозом | $270,000 | — |
| Трансплантация печени | $577,100 | — |
СООБРАЖЕНИЯ КОМИТЕТА P&T
Софосбувир — первый в своем классе ингибитор нуклеотида NS5B. Эффективность СОФ в достижении УВО была продемонстрирована в нескольких клинических испытаниях фазы 2 и 3; однако необходимо учитывать генотип ВГС.
У пациентов с генотипами 1 и 4, не получавших лечения, NEUTRINO показало 90% уровень УВО. При использовании SOF продолжительность лечения тройной терапией (SOF+PEG+RBV) может быть сокращена до 12 недель с гораздо меньшим количеством побочных эффектов по сравнению с прошлым стандартом лечения с использованием PEG, RBV и либо телапревира, либо боцепревира. Кроме того, для пациентов, не подходящих для PEG, или тех, у кого лечение PEG+RBV не дало результата, лечение SOF и симепревиром может привести к уровню УВО от 93% до 100%.
У пациентов с генотипом 2, ранее не получавших лечения, SOF обеспечивает более высокие показатели УВО по сравнению с прошлым стандартом лечения с использованием пегинтерферона и рибавирина. FISSION продемонстрировал 97% показатель УВО у пациентов с генотипом 2, получавших SOF и RBV в течение 12 недель, по сравнению с 78% получавших PEG и RBV в течение 24 недель. У пациентов, ранее получавших лечение (предыдущие нулевые ответы) или у тех, кто не мог использовать PEG, как FUSION, так и POSITRON продемонстрировали высокие показатели УВО в диапазоне от 86% до 93%.
Пациенты с генотипом 3 не имеют такого же надежного ответа на SOF и требуют расширенной продолжительности лечения в 24 недели. В основных клинических испытаниях у пациентов, не получавших лечение, показатели SVR составляли от 56% до 62%. Но когда продолжительность лечения была увеличена в последующих исследованиях, SOF и RBV в течение 24 недель продемонстрировали улучшенные показатели SVR в 84%.
Софосбувир имеет следующие преимущества:
Препарат высокоэффективен у пациентов с генотипом 2.
Он обеспечивает более короткую продолжительность лечения для пациентов с генотипом 1.
Его легко принимать (одна таблетка один раз в день).
Препарат имеет благоприятный профиль побочных эффектов.
Существует высокий барьер сопротивления.
Его изучали в сочетании с другими противовирусными препаратами прямого действия для схем лечения без интерферона.
Он входит в число всех рекомендаций по лечению гепатита С первой линии, содержащихся в рекомендациях Американского общества инфекционных заболеваний и Американской ассоциации по изучению заболеваний печени от 2014 года.
Недостатками являются отсутствие улучшения показателей УВО для пациентов с генотипом 3 и высокая стоимость лечения. Хотя цена значительно выше, чем у других вариантов лечения, необходимо учитывать стоимость УВО, а не только стоимость приобретения лекарств. Пациенту, который не поддается некачественному лечению, в конечном итоге придется либо снова лечиться дорогими противовирусными препаратами, либо нести расходы на жизнь с декомпенсированным циррозом или трансплантацией печени, что значительно превышает текущую стоимость лечения новыми пероральными ПППД.
ЗАКЛЮЧЕНИЕ
Препарат софосбувир зарекомендовал себя как эффективное средство в борьбе с гепатитом С. Софосбувир цена и инструкция доступны на нашем сайте. Для получения более подробной информации о том, где купить софосбувир в России, обратитесь к нашим специалистам.
Софосбувир, новый противовирусный препарат, эффективный против нескольких генотипов вируса гепатита С, может сыграть важную роль в лечении как пациентов, не получавших лечения, так и пациентов, прошедших лечение. Схемы SOF предлагают безинтерфероновый вариант при инфекциях генотипов 2 и 3. При инфекциях генотипов 1 и 4 использование SOF может снизить нагрузку на таблетки, продолжительность лечения и профиль побочных эффектов по сравнению с прошлым стандартом лечения. SOF можно использовать в сочетании с другими DAA, чтобы обеспечить безинтерфероновый вариант также при инфекциях генотипа 1, согласно рекомендациям 2014 года по лечению гепатита С. Софосбувир является первым DAA, одобренным FDA для пациентов с коинфекцией ВИЧ и тех, кто ожидает трансплантации печени.
Несколько испытаний оценивают использование SOF с другими пероральными DAA, которые обеспечат дополнительные полностью пероральные схемы лечения без интерферона для инфекций генотипа 1. Более того, ожидается, что SOF будет доступен в виде фиксированной комбинации с ледипасвиром к концу 2014 года. Парадигма лечения хронического гепатита С быстро меняется, и софосбувир будет играть важную роль в ближайшем будущем.
