Терапия энзалутамидом при распространенном раке простаты: эффективность, резистентность и не только
Обзор:
Рецептор андрогена стимулирует рост метастатического рака простаты, резистентного к кастрации. Это привело к разработке множества новых препаратов, нацеленных на этот гормон-регулируемый
фактор транскрипции, таких как энзалутамид – мощный антагонист андрогенных рецепторов. Несмотря на множество возможных вариантов лечения, абсолютная польза от каждого метода лечения
в отдельности ограничена несколькими месяцами. Таким образом, текущие исследовательские усилия направлены на определение оптимальной последовательности терапии, открытие новых лекарств,
эффективных при метастатическом кастрационно-резистентном раке простаты, и определение субпопуляций пациентов, которые в конечном итоге получат пользу от этих методов лечения.
Молекулярные исследования предоставляют доказательства того, какие пути опосредуют резистентность к лечению и могут привести к улучшению лечения метастатического резистентного
к кастрации рака простаты. В этом обзоре представлен, во-первых, краткий обзор клинического развития, использования и эффективности энзалутамида в лечении распространенного рака простаты,
во-вторых, он описывает трансляционные исследования, посвященные реакции на энзалутамид и резистентности, и, наконец, освещает новые потенциальные стратегии лечения в условиях устойчивости
к энзалутамиду.
Введение:
С тех пор, как было обнаружено, что рост рака предстательной железы (РПЖ) после андрогендепривационной терапии (АДТ) по-прежнему зависит от передачи сигналов андрогенных рецепторов (AR),
исследователи искали новые эффективные способы блокирования действия этого гормонозависимого транскрипционного фактора ( Attard et др. 2009 , Тран и др. 2009 , Шер и др. 2012 ).
При стимуляции андрогенами AR диссоциирует от своих молекулярных шаперонов и перемещается в ядро, где связывается с тысячами сайтов по всему геному человека, регулируя транскрипцию
непосредственно реагирующих генов, включая промитотические гены, участвующие в пролиферации опухолевых клеток.
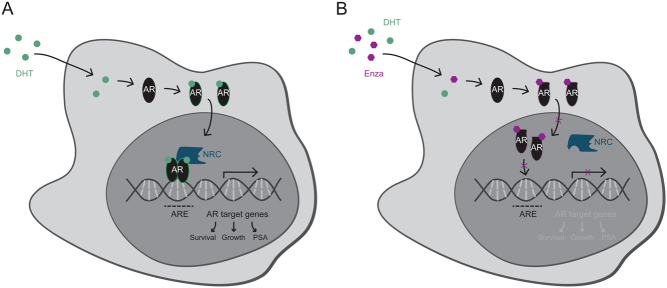
Рис. 1А) ( Бринкманн и др. 1999 , Итконен и Миллс 2012 , Миллс 2014 ).
 |
|
Сигнальная ось AR и механизм действия энзалутамида. (A) При связывании дигидротестостерона (DHT) AR димеризуется и перемещается в ядро, где он связывается с элементами AR-ответа (ARE)
и рекрутирует корегуляторы ядерных рецепторов (NRC), так называемые коактиваторы или корепрессоры, для регуляции транскрипции непосредственно реагирующие гены,
участвующие в пролиферации и выживании клеток. (B) Связывание энзалутамида (Enza) с лиганд-связывающим карманом AR приводит к конформационным изменениям,
делающим рецептор неспособным образовывать активный транскрипционный комплекс. Кроме того, энзалутамид блокирует ядерную транслокацию AR, и связанная с энзалутамидом
AR нарушается способность связываться с ДНК, что в конечном итоге предотвращает AR-зависимую экспрессию генов.
|
Подавление передачи сигналов андрогенов посредством АДТ первоначально приводит к регрессии опухоли в подавляющем большинстве случаев, но неизбежно опухолевые клетки адаптируются к низким уровням
андрогенов, что приводит к прогрессированию заболевания, которое известно как резистентность к кастрации (Harris et al. 2009, Massard & Fizazi 2011 ) . , Карантанос и др. 2013 ).
Мощные антиандрогены, которые либо воздействуют на АР напрямую посредством физической конкуренции с природным лигандом рецептора дигидротестостероном (ДГТ), либо косвенно посредством
ингибирования биосинтеза андрогенов, входят в число вариантов лечения метастатического резистентного к кастрации рака простаты (мКРРПЖ) (Helsen et al. 2014 ) . ).
На данный момент энзалутамид (MDV-3100) является наиболее часто назначаемым препаратом для лечения мКРРПЖ ( Sanford 2013 ). Этот препарат относится к классу прямых ингибиторов
андрогенных рецепторов и воздействует на путь AR во многих узлах: предотвращая связывание лигандов, блокируя ядерную транслокацию AR и ингибируя трансактивацию ДНК, что в конечном итоге
прекращает экспрессию генов, чувствительных к андрогенам.Рис. 1Б) ( Тран и др. 2009 , ван Соест и др. 2013 ). Многоэтапное действие энзалутамида на передачу сигналов AR считается основной
причиной его превосходной клинической активности по сравнению с другими прямыми ингибиторами AR, такими как флутамид, бикалутамид и нилутамид ( Antonarakis 2013 ).
Однако из-за гетерогенности РПЖ у разных пациентов, что широко признано основным недостатком эффективности терапии, реакция на лечение энзалутамидом варьируется у разных пациентов
( Boyd et al. 2012 ). В то время как некоторые пациенты не получают существенной клинической пользы от терапии энзалутамидом, у других, у которых она есть, прогрессирование начинается
через определенный период времени, что также зависит от последовательности терапии (Scher et al. 2012, Beer et al . 2014 , Merseburger et al . др., 2015 ).
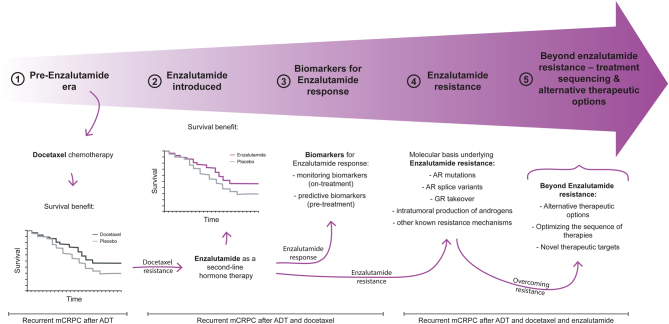
Этот обзор, содержание которого проиллюстрировано на Рис. 2(1–5), во-первых, дадут всестороннее представление об использовании энзалутамида в лечении распространенного РПЖ – от вариантов
лечения в эпоху до энзалутамида до его доклинической разработки и знаковых исследований, которые привели к его одобрению FDA. одобрение мКРРПЖ . В этой связи мы обсуждаем
трансляционные исследования, направленные на решение неудовлетворенных клинических потребностей в лечении распространенного РПЖ с использованием энзалутамида.
Это включает наличие биомаркеров во время лечения и прогностических биомаркеров для ответа на лечение; лучшее понимание молекулярных механизмов, лежащих в основе устойчивости к энзалутамиду ;
и, наконец, разработка новых терапевтических подходов, направленных на преодоление резистентности к терапии.
 |
|
Графическое резюме, отражающее темы, обсуждаемые в этом обзоре. Доцетаксел стал первым препаратом, продемонстрировавшим улучшение выживаемости у пациентов с мКРРПЖ (1). Несмотря на первоначальный ответ на химиотерапию доцетакселом, у пациентов со временем наблюдается прогрессирование, в результате чего было показано, что энзалутамид эффективен в таких условиях мКРРПЖ, резистентных к доцетакселу (2). Текущие усилия по трансляционным исследованиям направлены на разработку биомаркеров ответа на энзалутамид (3), понимание молекулярных основ мКРРПЖ, устойчивых к энзалутамиду (4) и оптимизацию стратегий лечения для преодоления резистентности к энзалутамиду (5).
|
Эпоха до энзалутамида:
Андрогенная депривационная терапия
АДТ является стандартом лечения пациентов с симптоматическим метастатическим РПЖ с сороковых годов прошлого века ( Merseburger et al. 2016 ). Однако, несмотря на первоначальный ответ на АДТ,
в конечном итоге практически у каждого пациента возникает резистентность, которая опосредована АР-зависимыми или независимыми путями ( Scher & Sawyers 2005 ). Первоначально два
ретроспективных исследования показали ограниченное преимущество продолжительной супрессии андрогенов аналогами рилизинг-гормона лютеинизирующего гормона (ЛГРГ) в условиях мКРРПЖ
( Taylor et al. 1993 , Hussain et al. 1994 ). На основании этих результатов все пациенты с мКРРПЖ, включенные в исследования, обсуждаемые ниже, продолжают андроген-супрессивную терапию.
Хотя данные ограничены, польза от продолжающейся депривации андрогенов перевешивает потенциальные риски прекращения терапии.
Химиотерапия:
В 2004 году исследование TAX-327 положило начало переходу к системному лечению мКРРПЖ ( Tannock et al. 2004 ). В этом исследовании фазы III 1006 пациентов с мКРРПЖ были рандомизированы
для приема преднизолона либо в сочетании с митоксантроном (химиотерапия, которая обеспечивает паллиативное лечение, но не приводит к улучшению выживаемости пациентов с кастрационно-резистентным
РПЖ (Tannock et al . 1996 ) или с доцетакселом (химиотерапия, которая, как сообщалось в исследованиях фазы II, успешно снижает уровни сывороточного простатспецифического антигена
(ПСА) Beer et al. 2001 , Berry et al. 2001 ).
В то время как митоксантрон, как ингибитор топоизомеразы типа II, который интеркалирует между основаниями ДНК и тем самым нарушает синтез и репарацию ДНК ( Nitiss 2009 , Pommier et al. 2010 ),
не связан напрямую с биологией AR, доцетаксел связан. Он принадлежит к классу таксанов химиотерапевтических агентов, которые связываются с тубулином и гиперстабилизируют микротрубочки,
что в конечном итоге приводит к нарушениям митотического клеточного цикла и передачи сигналов AR за счет предотвращения его ядерной транслокации (Kuroda et al. 2009, Zhu et al. 2010, Darshan et al
. 2010 , Darshan et al . др. 2011 , Фитцпатрик и де Вит 2014 ).
Исследование TAX-327 идентифицировало доцетаксел как первый химиотерапевтический препарат, показавший умеренное улучшение общей выживаемости (ОВ) по сравнению с митоксантроном.
Таблица 1) ( Бертольд и др. 2008 ). На основании этих результатов доцетаксел был признан вариантом терапии первой линии как для симптоматического, так и для бессимптомного мКРРПЖ.

Устойчивость к доцетакселу:
Как описано ранее, пациенты с мКРРПЖ, получающие химиотерапию на основе доцетаксела, имеют умеренное улучшение общей выживаемости, что означает, что у большинства пациентов прогресс
будет довольно быстрым. У пациентов с хорошим первоначальным ответом на терапию доцетакселом повторное назначение того же химиотерапевтического препарата приводит к повышению ПСА у 60%
пациентов со средним временем до прогрессирования 6 месяцев (Beer et al . 2004 ) . Поскольку этот ответ менее выражен по сравнению с терапевтическим эффектом в первом раунде,
можно также предположить, что эффективность повторной стимуляции доцетакселом будет продолжать снижаться до тех пор, пока его эффект не станет незначительным.
Механизмы, лежащие в основе этой резистентности к доцетакселу при мКРРПЖ, могут быть разнообразными ( Seruga et al. 2011 ). С одной стороны, они включают довольно общие механизмы,
связанные с устойчивостью к таксанам, включая измененный состав микротрубочек, влияющий на связывание доцетаксела (например, активация определенных изотипов Ranganathan et al. 1998 или
мутации Yin et al. 2010 ), снижение внутриклеточного накопления лекарственного средства. из-за сверхэкспрессии насосов оттока лекарств (таких как P-гликопротеин Zhu et al. 2013 )
или нарушения распределения лекарств из-за аберрантного ангиогенеза ( Marignol et al. 2008 ). С другой стороны, резистентность также может развиваться из-за механизмов,
присущих биологии мКРРПЖ, таких как продолжающаяся передача сигналов AR, которая стимулирует рост РПЖ и ингибирует апоптоз ( Seruga et al. 2011 ) или из-за активации
компенсаторных онкогенных путей (таких как PI3K/ AKT или MAPK/ERK Zhu & Kyprianou 2008 ), которые сами по себе связаны с пролиферацией и выживанием.
В результате резистентности к таксанам возникла необходимость в новых терапевтических подходах к лечению мКРРПЖ, резистентных к доцетакселу, и они пользовались большим спросом.
Энзалутамид как гормональная терапия второй линии:
Доклиническая разработка
С тех пор, как исследования молекулярного профилирования показали, что многие опухоли CRPC остаются управляемыми AR, возник большой интерес к выявлению новых и эффективных стратегий
для лучшего блокирования сигнальной оси AR ( Chen et al. 2004 ). Такие антиандрогены следующего поколения должны – в отличие от своих аналогов первого поколения (например, бикалутамида и флутамида)
– предпочтительно обладать более высоким сродством к AR-связыванию без каких-либо агонистических эффектов ( Chen et al. 2004 , Bambury & Scher 2015 ). В поисках таких улучшенных антиандрогенов
Tran et al. (2009) проверили около 200 тиогидантоиновых производных RU59063 – нестероидного агониста AR с относительно высоким сродством и селективностью по отношению к другим ядерным
рецепторам гормонов – на предмет сохранения активности в клетках рака простаты человека, которые сверхэкспрессируют белок AR, что также клинически наблюдается в кастрационная устойчивость
к заболеванию. RD162 и MDV3100 (теперь энзалутамид) были выбраны в качестве ведущих соединений для дополнительной биологической проверки, и, что важно, оба антиандрогена
приводили к регрессии опухоли на моделях ксенотрансплантатов ( Tran et al. 2009 ). Благодаря своим благоприятным свойствам, подобным лекарственным средствам, таким как
биодоступность при пероральном приеме и более длительный период полувыведения из сыворотки, энзалутамид был выбран для дальнейшей клинической разработки ( Bambury & Scher 2015 ).
Клинические испытания
Доклинически продемонстрированная противоопухолевая активность энзалутамида была впоследствии подтверждена в исследовании фазы I/II, в котором пациенты с прогрессирующим мКРРПЖ были включены в
когорты с увеличением дозы, что в конечном итоге продемонстрировало его безопасность и переносимость, а также противоопухолевый эффект при всех протестированных дозах ( Scher et др., 2010 ).
В 2012 году был опубликован предварительный анализ исследования AFFIRM, которое стало первым исследованием III фазы по энзалутамиду в условиях мКРРПЖ ( Scher et al. 2012 ). В этом исследовании 1199
пациентов с мКРРПЖ, у которых наблюдалось прогрессирование заболевания на терапии доцетакселом, были рандомизированы для приема энзалутамида или плацебо. Лечение энзалутамидом значительно
улучшило результаты лечения пациентов после терапии доцетакселом по сравнению с контрольной группой плацебо (Таблица 1).
Эффективность энзалутамида и его ограниченная токсичность по сравнению с химиотерапией могут быть достигнуты не только у пациентов с мКРРПЖ, ранее получавших доцетаксел, но также и у
пациентов, ранее не проходивших химиотерапию, как показано в исследовании PREVAIL (Beer et al . 2014 ) . Это было рандомизированное исследование III фазы, в котором приняли участие
1717 мужчин с мКРРПЖ, ранее не проходивших химиотерапию, и сравнивали терапию энзалутамидом с плацебо. И снова терапия энзалутамидом привела к значительному улучшению общей выживаемости и
выживаемости без рентгенологического прогрессирования (rPFS) (Таблица 1) ( Бир и др. 2017 ).
Кроме того, недавно были опубликованы результаты рандомизированного исследования III фазы PROSPER. При этом добавление энзалутамида или плацебо к продолжению АДТ было проверено на предмет его
способности задерживать образование метастазов у мужчин с неметастазирующим CRPC, которые подвергаются высокому риску развития отдаленных поражений. В этих условиях терапия энзалутамидом
привела к снижению риска метастазов или смерти на 71% по сравнению с плацебо ( Hussain et al. 2018 ).
Основываясь на этих результатах, энзалутамид в настоящее время является основным вариантом лечения КРРПЖ без метастазов и бессимптомного мКРРПЖ, тогда как доцетаксел в основном используется у
мужчин с симптоматическим метастазированием и приобретенной резистентностью к терапии первой линии (Ryan et al. 2013 , Beer et al . 2014 , Хуссейн и др. 2018 ) .
Биомаркеры ответа на энзалутамид
Определение уровней ПСА в качестве диагностического биомаркера уже было введено в 1980-х годах, но с тех пор также подвергалось сомнению, главным образом из-за его неспецифичности в
качестве маркера раковых поражений (Oesterling 1991, Salman et al . 2015 ) . Тем не менее, измерения ПСА в качестве биомаркера мониторинга ответа на лечение или резистентности после диагностики РПЖ
и соответствующих вмешательств регулярно используются в клинике. Было показано, что снижение ПСА по меньшей мере на 30% через 4 недели и >30% или >50% после 12 недель лечения коррелирует с
преимуществом в выживаемости, особенно у пациентов, получавших АР-нацеленные соединения, тогда как стабильные или повышенные уровни ПСА коррелировали с худший результат
( Scher et al. 2008 , Brasso et al. 2015 , Fuerea et al. 2016 , Rescigno et al. 2016 ). Более того, циркулирующие опухолевые клетки (ЦОК) кажутся многообещающим инструментом для прогнозирования
улучшения выживаемости, вызванного лечением. Было замечено, что пациенты со снижением количества ЦОК (>30%) после 4 недель терапии имеют лучший прогноз ( Scher et al. 2015 , Lorente et al. 2016 ,
Heller et al. 2017 , Prekovic et al. 2018 а ). Следовательно, ЦОК могут быть лучшим маркером резистентности к лечению в опухолях, прогрессирующих без очевидного повышения ПСА, принимая во
внимание, что необходима дальнейшая проверка, прежде чем их можно будет рекомендовать в повседневной клинической практике. Однако эти показания во время лечения позволяют отслеживать только
реакцию пациента, например, на терапию энзалутамидом. В то время как некоторые мужчины реагируют исключительно хорошо и продолжают лечение в течение нескольких лет, у других прогресс прогрессирует
в течение нескольких месяцев или даже не проявляется вообще никакого ответа ( Аттард и Антонаракис, 2016 ). Таким образом, для улучшения ведения пациентов с РПЖ срочно необходимы биомаркеры,
позволяющие идентифицировать субпопуляции пациентов, которым будет полезно лечение энзалутамидом.
Биопсия тканей оказалась высокоинформативной, особенно при первичном заболевании. Помимо систем классификации, основанных на клинических параметрах (таких как показатель Глисона, ПСА и
клиническая стадия) ( D'Amico et al. 1998 ), геномный анализ может предоставить биомаркеры оценки риска, которые стратифицируют пациентов с РПЖ по исходу ( Irshad et al. 2013 , Кнежевич и др.
2013 , Стеллоо и др. 2015 ). Однако метастатический ландшафт CRPC с преобладанием в костях делает их довольно непрактичными в рутинной клинической практике, и современные подходы почти
исключительно сосредоточены на минимально инвазивных биомаркерах крови ( Wyatt et al. 2016 ). До сих пор несколько исследований показали, что профилирование ЦОК или внеклеточной опухолевой
ДНК (вкДНК) в жидкой биопсии позволяет выявлять варианты сплайсинга AR, увеличение числа копий AR и мутации AR , все из которых, по крайней мере, связаны с устойчивостью к энзалутамиду.
и худший прогноз ( Шварценбах и др. , 2009 , Антонаракис и др., 2014 , Диас и Барделли, 2014 , Салви и др., 2016 , Wyatt и др. , 2016 , Контедука и др., 2017 ). Тем не менее, ни один такой
биомаркер до сих пор не внедрен и не используется регулярно в клинике, и для потенциального изменения практики необходимы дальнейшие исследования, которые надежно подтвердят каждый
биомаркер в проспективной манере ( Attard & Antonarakis 2016 ).
Молекулярная основа устойчивости к энзалутамиду
Исследования AFFIRM и PREVAIL ясно продемонстрировали преимущества лечения энзалутамидом. Однако 46 (AFFIRM) и 22% (PREVAIL) пациентов с мКРРПЖ не ответили на лечение
энзалутамидом второй или первой линии, а это означает, что их уровни ПСА не снизились на ≥50% от исходного уровня. Остальные 54 и 78% пациентов, получавших энзалутамид,
ответили первоначально, но прогрессирование ПСА можно было наблюдать через медианное время 8,3 месяца (AFFIRM) и 11,2 месяца (PREVAIL) (Scher et al. 2012 , Beer et al . 2014 ) .
Механизмы, лежащие в основе ранее существовавшей или приобретенной устойчивости к энзалутамиду, до сих пор полностью не выяснены, но было предложено несколько возможных механизмов
( Claessens et al. 2014 ). В следующем разделе мы кратко обсудим такие потенциальные механизмы, которые подробно обсуждаются в Prekovic et al. (2018б ) .
AR-мутации
Мутации усиления функции в гене AR , особенно в экзоне 7 (кодирующем лиганд-связывающий домен), были обнаружены у 5–30% пациентов с CRPC
( Taplin et al. 1999 , Coutinho et al. 2016 , Кумар и др. 2016 , Раткопф и др. 2017 , Пал и др. 2018 ). Эти геномные изменения не только позволяют активировать рецептор
различными циркулирующими стероидами рядом с тестостероном (такими как H875Y или T878A), но также могут изменить чувствительность AR к антиандрогенам, что приводит к
переключению с антагониста на агонист (Grossmann et al. 2001 ) . , Надаль и др. 2017 , Прекович и др. 2018 а ). Примером этого являются двойные мутанты F877L/T878A и M896V/S889G,
которые были связаны с резистентностью ( Lallous et al. 2016 , Prekovic et al. 2016 ) и недавно были обнаружены в вкДНК, выделенной из плазмы пациентов с мКРРПЖ, прогрессирующих
на терапии энзалутамидом. ( Азад и др., 2015 г. , Вятт и др., 2016 г. ).
Варианты сращивания AR
Сообщалось, что альтернативно сплайсированные варианты AR, особенно AR-V7, участвуют в устойчивости к препаратам, нацеленным на AR, включая энзалутамид.
AR-V7 представляет собой изоформу AR, в которой отсутствует лиганд-связывающий домен (LBD), что делает вариант конститутивно активным и устойчивым к ингибиторам,
нацеленным на LBD ( Guo et al. 2009 , Hu et al. 2009 , Antonarakis et al. 2016 ). ). Многочисленные исследования показали, что экспрессия AR-V7 является биомаркером
устойчивости к препаратам, нацеленным на AR, при CRPC ( Li et al. 2013 , Scher et al. 2016 , Antonarakis et al. 2017 , Del Re et al. 2017 , Qu et al. 2017 , Todenhofer et al. 2017 ),
но до сих пор остается неясным, является ли AR-V7 движущей силой резистентности или это просто проявление селективного давления, вызванного лечением, но не
являющееся ключевым фактором неудачи терапии.
Захват глюкокортикоидных рецепторов
Сообщалось, что глюкокортикоидный рецептор (GR) активируется или повторно экспрессируется после блокады AR, что указывает на сложное перекрестное взаимодействие между биологией AR и GR.
Из-за большого сходства в механизме действия ядерных рецепторов предполагается, что GR берет на себя роль AR, управляя экспрессией подмножества генов, чувствительных к
андрогенам, что позволяет опухоли прогрессировать даже в присутствии AR-селективных генов. антагонист энзалутамид
( Arora et al. 2013 , Kach et al. 2015 , Li et al. 2017 , Shah et al. 2017 , Puhr et al. 2018 ).
Внутриопухолевая продукция андрогенов
Кроме того, реактивация AR может происходить за счет внутриопухолевой продукции андрогенов, что позволяет раку простаты прогрессировать, несмотря на продолжающуюся
андрогенную депривацию ( Locke et al. 2008 ). Экспрессия одного из важнейших ферментов биосинтеза андрогенов, AKR1C3, была значительно повышена в энзалутамид-резистентных
клетках и ксенотрансплантатных опухолях, а также в клинических образцах распространенного РПЖ, что делает его привлекательной терапевтической мишенью
(Wako et al. 2008 , Pfeiffer et al . др. 2011 , Хамид и др. 2013 , Лю и др. 2015 , 2017 ). Ингибирование AKR1C3 как новая терапевтическая стратегия в настоящее время
изучается в клиническом исследовании (Nbib2935205), изучающем его потенциальную пользу в сочетании с терапией энзалутамидом при мКРРПЖ ( Pan et al. 2018 ).
Другие известные механизмы сопротивления
Помимо вышеупомянутых оснований резистентности к энзалутамиду, связанных с АР, было описано несколько дополнительных механизмов, вызывающих резистентность
к терапии, но они не входят в рамки данного обзора. Среди них очень разнообразные адаптации, такие как метаболические изменения (например, переход к аэробному гликолизу
Cui et al., 2014 или изменения в пути биосинтеза гексозамина, Itkonen et al., 2016 ), а также аутофагия ( Nguyen et al., 2014 ) или активация определенных сигнальные
пути (такие как Wnt Lee et al. 2015 или интерлейкин 6 Liu et al. 2014 b ) – все они подробно рассмотрены в Prekovic et al. ( 2018б ) .
Помимо устойчивости к энзалутамиду: последовательность терапии и альтернативные варианты лечения
График лечения энзалутамидом у пациентов с мКРРПЖ может сильно различаться; в зависимости от стадии РПЖ пациента, общего состояния здоровья, истории лечения и личных предпочтений (Рис. 3).
Таким образом, механизмы устойчивости к энзалутамиду (или другим антагонистам АР) также могут различаться, поскольку они могут зависеть от условий, в которых вводился препарат.
За последнее десятилетие было разработано несколько методов лечения, хотя оптимальная последовательность методов лечения еще предстоит определить. Это особенно актуально, поскольку ни один из
доступных терапевтических вариантов, описанных в Таблица 2еще не сравнивались в клинических исследованиях ( Sartor & Gillessen 2014 ).


Доступные терапевтические возможности в клинической практике
Нет сомнений в том, что у пациентов с мКРРПЖ, ответивших на энзалутамид, результаты значительно улучшились. Тем не менее, несмотря на улучшение выживаемости, состояние пациентов все еще
прогрессирует, а улучшение показателей абсолютной выживаемости весьма разочаровывает. Помимо энзалутамида, за последние 10 лет было разработано несколько других терапевтических вариантов
с доказанной пользой для пациентов с мКРРПЖ, которые обобщены в Таблица 2 и будет кратко рассмотрено далее.
Кабазитаксел - Кабазитаксел, как и доцетаксел, представляет собой таксан, который стабилизирует микротрубочки и, следовательно, нарушает митотическое деление клеток.Рис. 4А)
( Фицпатрик и де Вит 2014 , Куинн и др. 2017 ). Тем не менее, препарат проявляет противоопухолевую активность на моделях, устойчивых к доцетакселу,
возможно, из-за того, что кабазитаксел является плохим субстратом для P-гликопротеина откачивающего насоса лекарства, который, как сообщается, способствует устойчивости к доцетакселу
(Paller & Antonarakis 2011 ) . В соответствии с этим было показано, что кабазитаксел улучшает выживаемость у пациентов с мКРРПЖ с прогрессирующим заболеванием во время или после
вмешательства на основе доцетаксела ( de Bono et al. 2010 , Bahl et al. 2013 ).
Рисунок 4
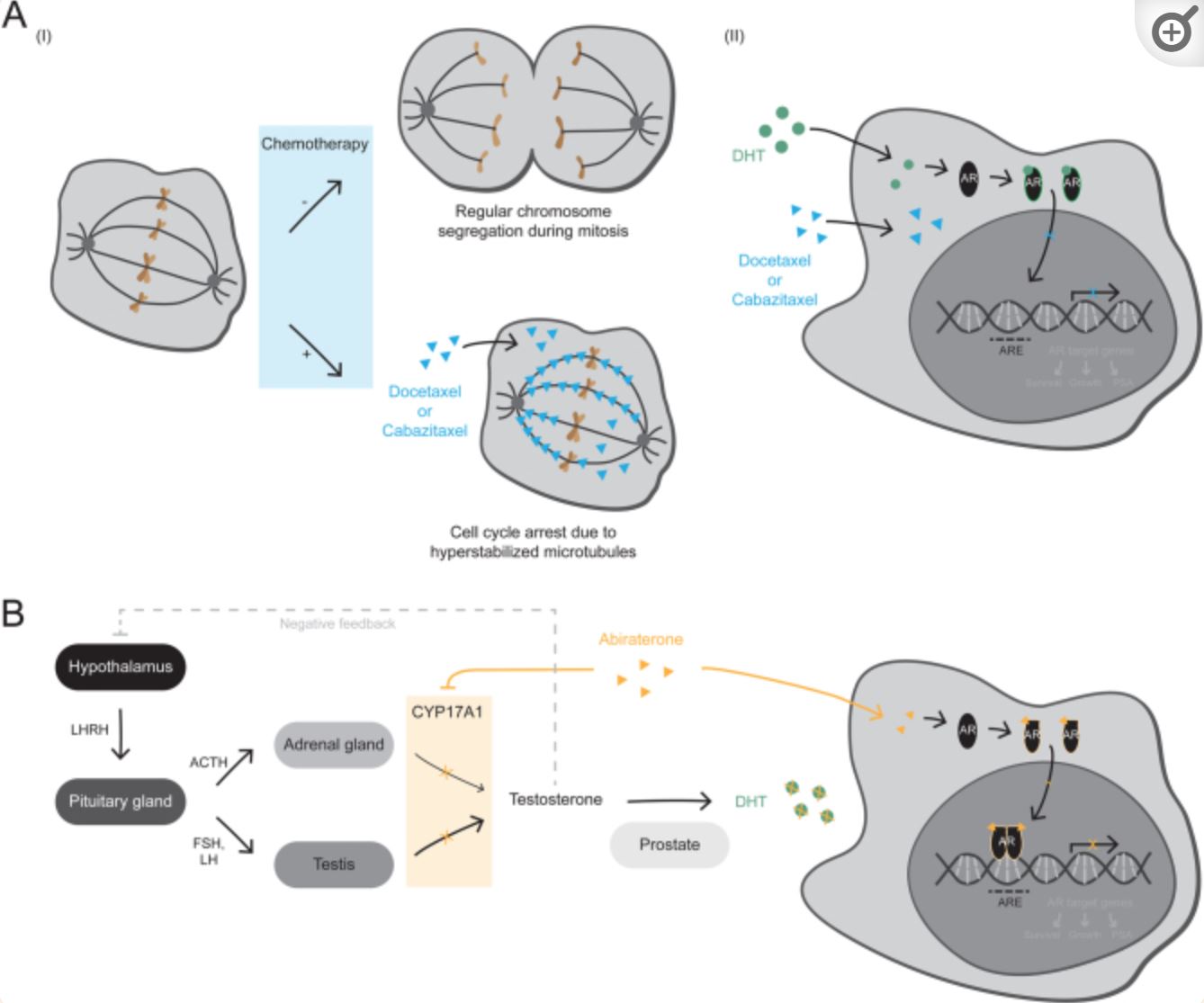
Механизмы действия таксановых химиотерапевтических средств и антиандрогена абиратерона ацетата. (А) Таксановые химиотерапевтические препараты, такие как доцетаксел и кабазитаксел,
действуют посредством гиперстабилизации микротрубочек, что – из-за роли микротрубочек в сегрегации хромосом во время митоза – вызывает остановку клеточного цикла в метафазе
с последующим апоптозом. Более того, таксаны напрямую влияют на передачу сигналов AR, ингибируя зависимую от микротрубочек ядерную транслокацию AR в ответ на стимуляцию андрогенами.
(AR — андрогенный рецептор; ARE — элемент AR-ответа; DHT — дигидротестостерон). (B) Абиратерон представляет собой ингибитор цитохрома P450 17A1 (CYP17A1), который приводит к
андрогенной депривации путем ингибирования внутриклеточного биосинтеза андрогенов в семенниках и надпочечниках. Андрогены вырабатываются через систему гипоталамус-гипофиз-яички
и в небольшой степени также через систему гипоталамус-гипофиз-надпочечники. Внутри этих осей CYP17A1 отвечает за преобразование холестерина в андрогены, такие как тестостерон,
который в предстательной железе восстанавливается до мощного агониста AR ДГТ. Помимо андрогенной депривации, абиратерон способен напрямую взаимодействовать с AR и тем самым
блокировать передачу сигнала этого гормон-зависимого фактора транскрипции. (АКТГ — адренокортикотропный гормон; ФСГ — фолликулостимулирующий гормон; ЛГ — лютеинизирующий
гормон; ЛГРГ — рилизинг-гормон лютеинизирующего гормона; NRC — корегулятор ядерных рецепторов).
Абиратерона ацетат - Абиратерона ацетат (далее именуемый абиратероном) воздействует на сигнальную ось AR путем ингибирования цитохрома P450 17A1 (CYP17A1) –
фермента, участвующего во внутриклеточном биосинтезе андрогенов, который позволяет клеткам рака простаты обходить андрогенную депривацию.Рис. 4Б)
( Монтгомери и др. 2008 , Аттард и др. 2009 , Хелсен и др. 2014 ). Кроме того, было продемонстрировано, что абиратерон и одно из его метаболических производных
способны напрямую связываться с AR и тем самым ингибировать передачу сигнала этого лиганд-зависимого фактора транскрипции ( Richards et al. 2012 , Soifer et al. 2012 ,
van Soest и др. 2013 , Ли и др. 2015 ). Несколько крупных клинических исследований показали его эффективность при метастатическом РПЖ, не получавшем гормонов ( Fizazi et al. 2017 , James et al. 2017 ), а также при химиотерапии ( Ryan et al. 2015 ) и после приема доцетаксела ( Fizazi и др. 2012 ) настройка мКРРПЖ.
Сипулейцел-Т - Сипулейцел-Т — это иммунотерапия рака на основе аутологичных клеток, при которой иммунная система пациента перепрограммируется на распознавание и
уничтожение раковых клеток ( Higano et al. 2010 ). Во время процедуры антигенпрезентирующие клетки выделяют из крови и подвергают ex vivo распознаванию кислой фосфатазы
простаты — фермента, сверхэкспрессируемого при раке простаты, — после чего активированные иммунные клетки реинфузируют пациенту.Рис. 5А) ( Ди Лоренцо и др. 2011 , Хэнди и
Антонаракис 2018 ). В ходе исследования III фазы эта терапевтическая противораковая вакцина продлила выживаемость у пациентов с мКРРПЖ с бессимптомным или минимально
симптоматическим заболеванием, что сделало ее первым иммунотерапевтическим подходом, продемонстрировавшим улучшение выживаемости при РПЖ ( Kantoff et al. 2010 ).
Однако до сих пор применение Сипулейцела-Т тестировалось только одновременно с терапией энзалутамидом или перед ней (Nbib1981122), где обе схемы лечения, по-видимому,
приводят к одинаково устойчивым иммунным ответам без различий в средней выживаемости (Antonarakis et al . 2018 , Petrylak et др., 2018 ). Таким образом, до сих пор
Сипулейцел-Т рассматривается в качестве терапевтического варианта перед доцетакселом и энзалутамидом, как рекомендовано Европейской консенсусной группой экспертов,
если только дальнейшие исследования не продемонстрируют его эффективность в условиях мКРРПЖ, резистентного к энзалутамиду (Fitzpatrick et al . 2014 ) .
Рисунок 5
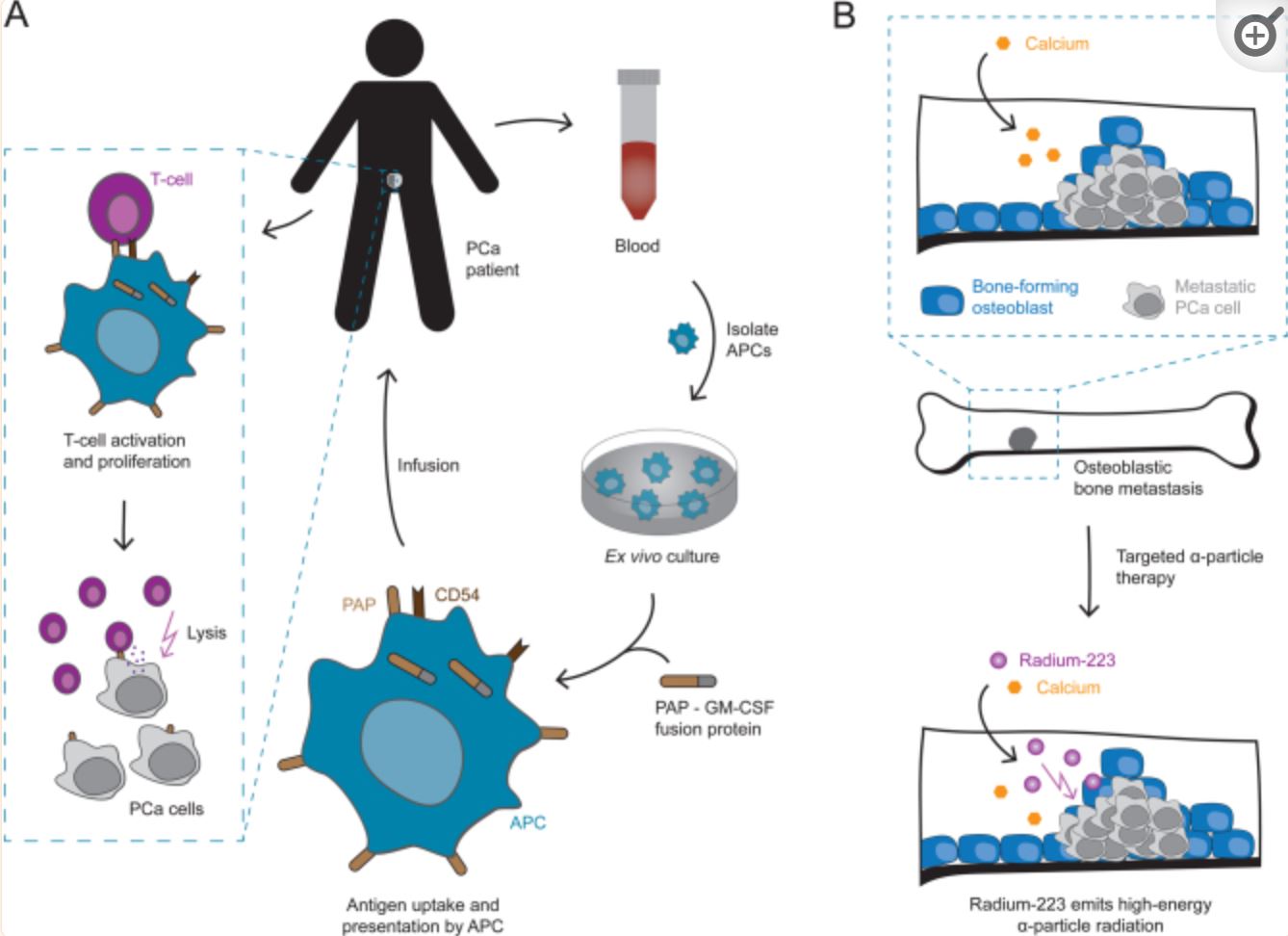
Механизмы действия Сипулейцела-Т и Радия-223. (A) Сипулейцел-Т представляет собой иммунотерапию рака, в которой используются аутологичные антигенпрезентирующие клетки
(АПК) для активации иммунной системы пациента против клеток РПЖ. Дендритные клетки, наиболее эффективные APC, выделяют из образцов крови и культивируют ex vivo вместе с рекомбинантным слитым
белком, состоящим из простатической кислой фосфатазы (PAP) – фермента, сверхэкспрессируемого при РПЖ; и гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) –
цитокин, усиливающий иммунные реакции. APC поглощают эти антигены, представляют их на своей поверхности и после активации экспрессируют поверхностный маркер кластера дифференциации 54
(CD54) – гликопротеин, который участвует во взаимодействиях APC с Т-клетками. Активированные APC затем реинфузируются пациенту, чтобы вызвать ответ Т-клеток против PAP-экспрессирующих
клеток РПЖ. (B) Таргетная терапия альфа-частицами радием-223 является вариантом лечения симптоматических пациентов с мКРРПЖ и скелетными метастазами. Радий-223 — это радиоактивный
аналог кальция, который, как и сам кальций, включается остеобластами в костный матрикс. Это особенно происходит в местах повышенного костеобразования, как это обнаруживается при
костных метастазах рака простаты, где радий-223 испускает высокоэнергетическое излучение альфа-частиц, которое вызывает серьезное повреждение ДНК в близлежащих клетках.
Радий-223У симптоматических пациентов с мКРРПЖ и скелетными метастазами дихлорид радия-223 (Радий-223) является дополнительным терапевтическим вариантом, улучшающим выживаемость
( Parker et al. 2013 ). Радий-223 представляет собой миметик кальция, проникающий в кости, который концентрируется в областях повышенного костного обмена, как это обнаружено в
остеобластных костных метастазах рака простаты, где он испускает высокоэнергетическое излучение альфа-частиц, которое вызывает серьезное повреждение ДНК в близлежащих клетках.Рис. 5Б)
( Хенриксен и др. 2002 , Бруланд и др. 2006 , Паркер и др. 2013 , Дешайес и др. 2017 ).
Терапия в клинической разработкеАнтиандрогены апалутамид (ARN-509) ( Dellis & Papatsoris 2018 ) и даролутамид (ODM-201) ( Shore 2017 ) — два новых терапевтических средства,
которые в настоящее время проходят клинические исследования. В то время как структура апалутамида очень похожа на структуру энзалутамида, даролутамид структурно отличается.
Тем не менее, оба новых антиандрогена обладают более высоким сродством к AR LBD и меньшим проникновением через гематоэнцефалический барьер по сравнению с энзалутамидом.
Это должно снизить риск судорог – распространенного побочного эффекта нестероидных антиандрогенов, возможно, из-за нецелевого связывания с рецепторами ГАМК А в головном мозге
( Imamura & Sadar 2016 ), которые в начальной фазе I/II дозы Исследование -эскалации произошло примерно у 2,1% пациентов, получавших энзалутамид (3 из 140), однако все они получали дозы,
которые более чем в два раза превышали утвержденную позже дозу 160 мг/день (Scher et al . 2010 , Хигано и др. 2015 ). Результаты плацебо-контролируемого исследования III фазы
показали значительное улучшение выживаемости без метастазов и времени до прогрессирования симптомов при лечении апалутамидом у мужчин с неметастатическим КРРПЖ (Smith et al . 2018 ) .
Аналогичным образом, в настоящее время проводится исследование эффективности даролутамида в этих условиях (Nbib2200614).
Еще одним препаратом, который в настоящее время изучается в отношении преодоления устойчивости к энзалутамиду, является никлозамид. Это одобренный FDA противогельминтный препарат,
который был идентифицирован как мощный ингибитор AR-V7 в клетках РПЖ, что приводит к ингибированию роста клеток РПЖ in vitro и ингибированию роста опухоли in vivo . Кроме того,
при назначении в сочетании с энзалутамидом никлозамид может повторно сенсибилизировать опухоли, устойчивые к энзалутамиду, к антиандрогену ( Liu et al. 2014a ). В настоящее время
безопасность и фармакокинетика комбинированной терапии проверяются в исследованиях фазы I (Nbib2532114, Nbib3123978), в которых недавно сообщалось, что плохая биодоступность никлозамида
при пероральном приеме ограничивает его эффективность (Schweizer et al . 2018 ) . Таким образом, нынешняя пероральная форма никлозамида может быть недостаточно эффективной в качестве
вмешательства в отношении mCRPC, что демонстрирует важность дальнейших клинических испытаний наряду с разработкой аналогов никлозамида с улучшенными фармакокинетическими и противоопухолевыми
свойствами (Schweizer et al . 2018 ) .
В совокупности существует – по крайней мере теоретически – несколько альтернативных вариантов лечения пациентов с мКРРПЖ, у которых заболевание прогрессировало во время или после
лечения энзалутамидом. Однако при выборе подходящего последующего варианта лечения необходимо учитывать возможную перекрестную резистентность, особенно среди антиандрогенов следующего
поколения. Более того, потенциальное снижение клинической эффективности препарата может произойти, если он используется в качестве вмешательства второй или третьей линии, что
подчеркивает важность оптимального планирования лечения.
Оптимизация последовательности терапии
Внедрение вышеупомянутых новых эффективных методов лечения добавило дополнительное измерение к сложному терапевтическому ландшафту мКРРПЖ. Поскольку все они доказали свои преимущества в выживаемости, можно создать разнообразные сценарии терапевтических вмешательств, но до сих пор остается неясным, как лучше всего упорядочить и/или объединить эти варианты лечения.
Клинические и трансляционные исследования по изучению схемы включения энзалутамидаПоскольку обсуждение всех текущих клинических исследований совместного лечения энзалутамидом выходит за рамки данного обзора, мы составили неисчерпывающий список клинических исследований, зарегистрированных на сайте Clinicaltrials.gov (дополнительную таблицу 1, см. раздел, посвященный дополнительным данным ) . в конце этой статьи). Здесь мы сосредоточимся на ограниченном количестве исследований, в которых сравнивается эффективность различных вариантов лечения с целью определения оптимальной последовательности лечения. Одним из таких исследований является продолжающееся исследование OSTRICh, в котором пациенты с плохими прогностическими характеристиками, у которых наблюдалось прогрессирование на терапии доцетакселом, рандомизированно распределяются между кабазитакселом и энзалутамидом или абиратероном (Nbib3295565).
Последовательное лечение различными агентами, нацеленными на АР, показало ограниченную эффективность, о чем свидетельствуют умеренные ответы ПСА при последовательном лечении энзалутамидом и абиратероном или наоборот ( Lriot et al. 2013 , Noonan et al. 2013 , Bianchini et al. 2014 , Schrader et al. 2014 г. , Брассо и др. 2015 г. , Ченг и др. 2015 г. , Петрелли и др. 2015 г. , Бадрисинг и др. 2016 г. a ) . Кроме того, предполагается, что доцетаксел имеет сниженную активность после предшествующей терапии энзалутамидом или абиратероном ( Mezynski et al. 2012 , Aggarwal et al. 2013 , Suzman et al. 2014 ).
Возможная схема комбинаторного лечения в настоящее время тестируется в исследованиях, оценивающих эффективность энзалутамида в сочетании с химиотерапевтическими препаратами на основе таксанов для лечения мКРРПЖ. Такая химиогормональная терапия доказала свою эффективность при метастатическом некастратном РПЖ до развития гормональной нечувствительности. В ходе исследований CHAARTED ( Sweeney et al. 2015 , 2016 , Kyriakopoulos et al. 2018 ) и STAMPEDE ( James et al. 2016 ) было показано, что предварительное добавление химиотерапии доцетакселом к АДТ при диагностике нелеченного метастатического РПЖ улучшает выживаемость по сравнению стандарту оказания помощи ADT. На основании этих результатов предварительное назначение доцетаксела в сочетании с АДТ считается вариантом лечения у мужчин с метастатическим раком предстательной железы, не имеющим гормонов de novo ( Gillessen et al. 2018a ) . Однако его польза в условиях мКРРПЖ остается неуловимой, поскольку такие химиогормональные комбинации (такие как энзалутамид + доцетаксел (Nbib1565928) или энзалутамид + кабазитаксел (Nbib2522715)) до сих пор тестировались только в исследованиях фазы I/II с относительно небольшими размерами выборки и следовательно, требуют дальнейшего изучения на более широкой популяции ( Morris et al. 2016 , Sternberg 2016 ).
До сих пор консенсус в отношении последовательности терапии при мКРРПЖ в основном основан на небольших ретроспективных исследованиях, которые не могут дать четкого ответа. Недавно в пострегистрационном исследовании оценивалась эффективность и безопасность лечения энзалутамидом у пациентов с мКРРПЖ, у которых ранее наблюдалось прогрессирование на абиратероне. При этом терапия энзалутамидом была полезна у некоторых пациентов, тогда как у большинства наблюдалась перекрестная резистентность между двумя гормональными препаратами ( de Bono et al. 2018 ). Аналогичные результаты были получены в ретроспективном исследовании, в котором ответ на энзалутамид был связан с более длительным интервалом между окончанием приема абиратерона и началом лечения энзалутамидом, что позволяет предположить, что с течением времени вероятность последующего ответа на энзалутамид потенциально увеличивается (Badrising et al. 2016 ) . б ).
На основании наблюдаемой перекрестной резистентности важно оценить, какой из вариантов эндокринного лечения более эффективен в качестве терапии первой линии для пациентов с мКРРПЖ. Этот вопрос в настоящее время рассматривается в исследовании ENABLE по раку простаты, многоцентровом рандомизированном контролируемом исследовании III фазы, в котором эффективность энзалутамида и абиратерона будет сравниваться лицом к лицу (Izumi et al . 2017 ) .
Кроме того, в настоящее время проводится рандомизированное контролируемое исследование (Nbib2125357), в котором оцениваются показатели ответа на ПСА у пациентов с мКРРПЖ, ранее не получавших терапию, которых последовательно лечили абиратероном и энзалутамидом или наоборот (Chi et al . 2017 ) .
Одновременное сочетание различных препаратов, нацеленных на АР, может повысить эффективность по сравнению с последовательным лечением. Это исследуется на пациентах, получающих монотерапию энзалутамидом или абиратероном, в сравнении с комбинированной терапией, состоящей из обоих антиандрогенов (Nbib1949337, Nbib1995513). Более того, несмотря на то, что в условиях ранее не применявшихся гормонов, обновление результатов исследования STAMPEDE ожидается с большими ожиданиями, поскольку оно включает группу с такой комбинированной терапией (Nbib268476, группа J).
Другой подход к повторному заражению мКРРПЖ, устойчивым к энзалутамиду, был описан Schweizer et al. (2015) и называется биполярной андрогенной терапией (БАТ). BAT использует адаптивное повышение уровня AR при CRPC, позволяя опухолевым клеткам справляться с кастрированными уровнями тестостерона, быстро переключаясь между андрогенной стимуляцией и депривацией. Последующее исследование II фазы БАТ у пациентов с мКРРПЖ, у которых прогрессировало лечение энзалутамидом, показало успешную повторную сенсибилизацию к препарату, когда пациентам повторно вводили антиандроген после прогрессирования терапии тестостероном (Teply et al . 2018 ) .
Текущие консенсусные рекомендации по лечению энзалутамидом и последовательности терапииКонсенсусная конференция по распространенному раку простаты в Санкт-Галлене (APCCC) помогает клиницистам в принятии терапевтических решений относительно ведения пациентов с распространенным раком простаты ( Gillessen et al. 2018 a , b ). Рекомендации, наиболее важные для данного обзора, обобщены в дополнительной таблице 2. Соответственно, энзалутамид рассматривается в качестве лечения первой линии у пациентов с бессимптомным мКРРПЖ, независимо от того, получали ли они АДТ отдельно или в сочетании с доцетакселом у пациентов, чувствительных к кастрации. параметр. Аналогичным образом, энзалутамид является препаратом первой линии для мужчин с симптомами, получавших доцетаксел в условиях, ранее не подвергавшихся кастрации; тогда как лечение доцетакселом, абиратероном или энзалутамидом является терапией выбора для пациентов с симптомами, которые не получали доцетаксел в этих условиях. Кроме того, был достигнут консенсус в отношении того, что как бессимптомные, так и симптоматические пациенты с мКРРПЖ, прогрессирующие во время или после химиотерапии доцетакселом первой линии, должны получать либо энзалутамид, либо абиратерон в качестве препарата второй линии.
Новые терапевтические цели
В дополнение к клинически используемым альтернативам энзалутамиду, описанным ранее, в настоящее время разрабатывается несколько стратегий лечения. Ниже обсуждаются исследования с наиболее многообещающими (предварительным) клиническими данными и/или текущие клинические испытания.
В клинической разработкеНедавно полный экзомный и транскриптомный анализ распространенного РПЖ показал, что у 89% из 150 пациентов с мКРРПЖ наблюдались клинически целевые отклонения ( Robinson et al. 2015 ). Помимо хорошо известных, часто встречающихся аберраций ( AR , ETS , TP53 и PTEN ), у пациентов с mCRPC было обнаружено большое количество новых геномных изменений, включая PIK3CA/B, R-спондин, BRAF/RAF1, APC, β-катенин и ZBTB16/PLZF . Более того, гены, участвующие в восстановлении повреждений ДНК ( BRCA2 , BRCA1 и ATM ), изменялись чаще, чем ожидалось ( Robinson et al. 2015 ). Совсем недавно Притчард и др. (2016) обнаружили, что 11,8% пациентов с метастатическим раком предстательной железы унаследовали мутации зародышевой линии в генах восстановления повреждений ДНК, которые, по-видимому, эффективно поддаются лечению ингибитором PARP олапарибом (Mateo et al . 2015 ) . Вследствие выявления этих геномных изменений в мКРРПЖ существует большой интерес к разработке клинических исследований, нацеленных на эти пути в сочетании с лечением энзалутамидом. Исследования, которые проводятся в настоящее время, включают ингибирование пути PI3K/AKT/mTOR с использованием LY3023414 (Nbib2407054), ингибирование пути рецептора TGF-β I с помощью галунисертиба (Nbib2452008) и ингибирование пути IGF1 с использованием ксентузумаба (Nbib2204072).
мКРРПХ также характеризуется изменениями эпигенетического статуса и статуса хроматина, такими как изменение ацетилирования гистонов или метилирования ДНК, на основании чего ридеры/модификаторы хроматина рассматриваются как потенциальные терапевтические мишени (Li et al. 2005, Metzger et al . 2005 , Spans et al . 2016 , Беннетт и Лихт 2018 ). Следовательно, семейство белков BET, которые распознают и связывают ацетилированные гистоны и участвуют в процессах регуляции транскрипции, являются потенциальными терапевтическими мишенями ( Padmanabhan et al. 2016 ). В частности, BRD4, консервативный член семейства читателей хроматина BET, играет решающую роль в глобальной транскрипции, опосредованной РНК-полимеразой II (RNA-Pol II) ( Jang et al. 2005 , Asangani et al. 2014 ). Ингибирование рекрутирования BRD4 в активный хроматин приводит к вытеснению РНК-Pol II из его генов-мишеней и в конечном итоге приводит к эффектам ингибирования роста в моделях ксенотрансплантата CRPC ( Filippakopoolos et al. 2010 , Asangani et al. 2014 , 2016 , Welti et al. 2018 ). ). Кроме того, BRD4 может физически взаимодействовать с N-концевым доменом AR, опосредуя его транскрипционную передачу сигналов ( Yang et al. 2005 , Asangani et al. 2014 , Urbanucci et al. 2017 ). Таким образом, были начаты клинические исследования, изучающие безопасность, фармакодинамику, фармакокинетику и клинические ответы на ингибитор BET (GSK525762) в качестве монотерапии (Nbib1587703) или в сочетании с антиандрогенами (Nbib3150056) у мужчин с CRPC, ранее не получавшими химиотерапию или получавшими химиотерапию.
Различные типы иммунотерапии, например антитела против PD-L1, исследуются практически при всех типах рака, показывая наибольшую эффективность при опухолях с высокой мутационной нагрузкой и иммунологически «горячим» опухолевым микроокружением (Hodi et al. 2010 , Powles et al . др. 2014 , Ризви и др. 2015 , Спрангер 2016 ). Однако РПЖ обычно характеризуется относительно «холодным» микроокружением с небольшой инфильтрацией цитотоксических Т-клеток ( Wargo et al. 2016 ). Более того, частота мутаций сравнительно низка, что, возможно, ограничивает успешные иммунотерапевтические вмешательства опухолями простаты с недостаточной репарацией повреждений ДНК ( Sartor & de Bono 2018 ). Недавно Зехир и др. (2017) сообщили о случае пациента с раком простаты, резистентным к кастрации и энзалутамиду, который исключительно хорошо ответил на иммунотерапию против PD-L1. Проспективное клиническое секвенирование опухоли и образцов крови пациента выявило признаки дефицита репарации ДНК (MMR) в раковой ткани без явного основного соматического или зародышевого поражения пути MMR ( Zehir et al. 2017 ). Таким образом, в настоящее время в клинических исследованиях изучается безопасность и эффективность ингибирования контрольной точки PD-L1 в качестве монотерапии (с использованием авелумаба) у пациентов с метастатическим нейроэндокринноподобным РПЖ (Nbib3179410) и в качестве комбинированного лечения (с использованием атезолизумаба и энзалутамида) у пациентов с мКРРПХ (Nbib3016312).
На доклинической стадииПомимо воздействия на сам AR, трансляционные исследования в течение последних нескольких лет были сосредоточены на поиске вариантов лечения, влияющих на молекулы, которые связаны с сигнальным путем AR и, следовательно, необходимы для правильного действия AR. К настоящему времени идентифицированы сотни этих регуляторов и взаимодействий AR, все из которых могут представлять интерес для будущей разработки лекарств ( Heemers & Tindall 2007 , Paltoglou et al. 2017 , Stelloo et al. 2018 ). Ниже мы кратко обсудим стратегии терапевтического вмешательства с многообещающими доклиническими результатами, которые нацелены на подмножество корегуляторов AR и, таким образом, служат доказательством принципа.
Недавно было разработано несколько ингибиторов белка, связывающего E1A-связывающий гистон-ацетилтрансферазы (p300), и белка, связывающего ответный элемент цАМФ (CREB) (CBP), таких как GNE-049 (Jin et al. 2017 ) , A- 485 ( Ласко и др., 2017 ) и CCS1477 ( Пегг и др., 2017 ). CBP и p300 являются двумя тесно связанными и известными транскрипционными коактиваторами AR, которые, как предполагается, играют важную роль в прогрессировании РПЖ ( Debes et al. 2003 , Heemers et al. 2007 ). В доклинических исследованиях ингибиторы p300/CBP блокируют транскрипционную программу AR и пролиферацию клеток РПЖ в клеточных линиях, а также в моделях ксенотрансплантатов, устойчивых к кастрации ( Jin et al. 2017 , Lasko et al. 2017 , Pegg et al. 2017 ), подтверждая их потенциал. клиническое воздействие, которое необходимо дополнительно подтвердить в клинических испытаниях. Совсем недавно было начато исследование фазы I/II по оценке безопасности и биологической активности ингибитора p300/CBP CCS1477 в качестве монотерапии или в сочетании с абиратероном или энзалутамидом у пациентов с мКРРПЖ (Nbib3568656).
Другими коактиваторами AR, которые в настоящее время изучаются на предмет их потенциала в качестве терапевтических мишеней, являются коактиваторы стероидных рецепторов p160 SRC-1, SRC-2 и SRC-3 ( Lonard & O'Malley 2016 ). Сообщалось, что SRC-1 и SRC-3 сверхэкспрессируются в клеточных линиях РПЖ и клинических образцах, где уровни их экспрессии связаны со степенью опухоли и выживаемостью, специфичной для заболевания (Gnanaprgasam et al. 2001, Lonard & O'Malley 2016 ) . . Более того, эксперименты по нокдауну SRC-3 на мышах показали снижение роста опухоли, что указывает на его важность в пролиферации и прогрессировании рака простаты ( Zhou et al. 2005 , 2010 ). SRC-2 был предложен в качестве онкогена РПЖ на основе интегрированного геномного профилирования 218 опухолей простаты, иллюстрирующего, что амплификации, мутации или сверхэкспрессия гена SRC-2 происходят в 8% первичных и 37% метастатических поражений РПЖ ( Taylor et al. 2010 ) . Сравнительно недавно был разработан новый мощный низкомолекулярный ингибитор SRC (SI-2), который создает основу для дальнейшей (до)клинической проверки ( Song et al. 2016 ). Парадоксально, но не только ингибирование SRC, но и гиперстимуляция может использоваться для избирательного индуцирования гибели раковых клеток и ингибирования роста опухоли in vivo . Высокопроизводительный скрининг выявил небольшую молекулу (MCB-613), которая чрезмерно активирует программы транскрипции SRC, что приводит к чрезмерному клеточному стрессу в раковых клетках, которые в значительной степени зависят от правильного функционирования SRC (Wang et al . 2015 ) .
Хотя большинство вышеупомянутых новых терапевтических подходов представляют собой системное лечение, первоочередной интерес представляют вмешательства, которые конкретно влияют на приобретенные признаки РПЖ и, таким образом, ограничивают нецелевые эффекты. Слияние андроген-чувствительной трансмембранной протеазы серина 2 (TMPRSS2) и гомолога онкогена E26 вируса эритробластоза v-ets обнаруживается примерно в 50% случаев рака простаты, что делает его наиболее распространенной генетической аберрацией при РПЖ ( Tomlins et др., 2005 г. , Атлас генома рака, 2015 г. ). Слияние генов TMPRSS2-ERG приводит к сверхэкспрессии обычно слабо экспрессируемого главного транскрипционного фактора ERG, управляемого андроген-регулируемым промотором TMPRSS2 . Это считается ранним событием развития РПЖ и фенотипически приводит к повышенной миграции, инвазии и неполной дифференцировке клеток РПЖ по сравнению с доброкачественными эпителиальными клетками предстательной железы из-за измененного профиля транскрипции (Tomlins et al. 2008, Mounir et al . 2015 , Kron et al . 2017 ) . На данный момент опубликованы три доклинических подхода, использующих либо вакцину на основе пептидов, чтобы заставить иммунную систему пациента распознавать слияние TMPRSS2-ERG в качестве антигена ( Kissick et al. 2013 ); липосомальные нановекторы, содержащие TMPRSS2-ERG-специфичные миРНК ( Shao et al. 2012 ) или проницаемые для клеток пептиды, ингибирующие ERG, которые специфически блокируют ERG-опосредованную транскрипцию путем взаимодействия с его ДНК-связывающим доменом ( Wang et al. 2017 ). Однако необходимо изучить гораздо больше доклинических проверок и стратегий таргетинга, прежде чем этот терапевтический подход потенциально сможет перейти в клинику.
Хотя действие AR остается важным при мКРРПЖ, это не единственная целевая молекула, вызывающая это сложное заболевание. Действительно, все больше данных свидетельствует о том, что подгруппа антиандроген-резистентных опухолей демонстрирует нейроэндокринные особенности, которые, по-видимому, являются следствием вызванной лечением адаптации аденокарциномы с геномными и эпигеномными факторами, связанными со снижением активности AR и эпителиальной пластичности (Epstein et al . 2014 , Бельтран и др. 2016 ). Эффективность химиотерапии на основе платины уже предполагалась при мелкоклеточном нейроэндокринном РПЖ, и в настоящее время это изучается в исследовании (Nbib2208583), основанном на молекулярном фенотипе мКРРПЖ ( Aparicio et al. 2013 ).
Заключение и перспективы на будущее
Внедрение энзалутамида в качестве гормональной терапии второй линии у пациентов с мКРРПЖ привело к значительным улучшениям в лечении заболевания. Из-за гетерогенности опухоли продолжительность эффекта от лечения энзалутамидом варьируется у разных пациентов. В то время как некоторые мужчины реагируют очень хорошо и продолжают лечение в течение нескольких лет, у других быстро прогрессирует в результате резистентности к лечению. Растущее число текущих клинических исследований отражает успешные доклинические достижения в понимании механизмов устойчивости к энзалутамиду и открытии новых терапевтических целей для максимизации клинических результатов. Однако заболевание по-прежнему остается неизлечимым, и существующие варианты лечения, включая энзалутамид и его альтернативы, оказывают лишь умеренное влияние на выживаемость, подчеркивая, что многие аспекты заболевания остаются плохо изученными. Только поняв, какие механизмы лежат в основе резистентности к лечению, можно разработать надежные молекулярные или клинические биомаркеры, которые помогут принимать терапевтические решения и идентифицировать субпопуляции пациентов, которые получат от этого максимальную пользу. Таким образом, можно разработать хорошо продуманные терапевтические стратегии, включающие оптимальную последовательность и комбинацию терапии, адаптированную к потребностям пациента.









