- Контакты для обращений: Открыть WhatsApp
- Пн-Сб (10:00 - 18:00)
- info@aprazer.com.ru
Глобальные реальные доказательства эффективности софосбувира/велпатасвира как простого и эффективного метода лечения вирусного гепатита С: анализ 5552 пациентов из 12 когорт
Достижение устойчивого вирусологического ответа (УВО; излечение) у пациентов с гепатитом С с использованием простой схемы является ключом к тому, чтобы сделать возможной элиминацию к 2030 году. В самом крупном на сегодняшний день анализе в реальных условиях эффективность пангенотипического, панфибротического, однотаблеточного софосбувира/велпатасвира (SOF/VEL) один раз в день в течение 12 недель оценивалась в 12 клинических реальных когортах из различных географических регионов, условий и методов лечения. Оценивались факторы, влияющие на риск недостижения УВО.
Делимся советом:
Узнать Где можно купить?Методы:
В исследование были включены взрослые, получавшие лечение с помощью SOF/VEL 400/100 мг без рибавирина (Велакаст). Исследование показало высокую эффективность софосбувир велпатасвир без рибавирина при всех генотипах вируса. Все пациенты с HCV, достигшие 12 или 24 недели после лечения, были оценены на предмет SVR12/24. Факторы, связанные с недостижением SVR12/24 по вирусологическим причинам, были оценены с использованием логистического регрессионного анализа.
Инструкция по применению Велакаст (софосбувир/велпатасвир)
Состав и форма выпуска
Каждая таблетка содержит:
- Софосбувир - 400 мг
- Велпатасвир - 100 мг
Форма выпуска: таблетки, покрытые пленочной оболочкой
Схема приема
- Дозировка: 1 таблетка в сутки
- Длительность лечения: 12 недель
- Способ применения: внутрь, независимо от приема пищи
- Время приема: в одно и то же время каждый день
Показания к применению
Лечение хронического гепатита С:
- Все генотипы вируса (1-6)
- Пациенты без цирроза
- Пациенты с компенсированным циррозом
- Пациенты, ранее не получавшие лечение
- Пациенты после неуспешной терапии
Противопоказания
- Повышенная чувствительность к компонентам
- Беременность и период лактации
- Возраст до 18 лет
- Тяжелая почечная недостаточность
- Декомпенсированное заболевание печени
Особые указания
- Необходим регулярный врачебный контроль
- Контроль вирусной нагрузки через 4, 12 и 24 недели
- Не пропускать прием препарата
- Соблюдать полный курс лечения
- Информировать врача о всех принимаемых лекарствах
Результаты:
В целом, было включено 5552 пациента: 13,3% с опытом лечения; 20,7% с компенсированным циррозом; 30,2% с генотипом 1; 29,5% с генотипом 2; 32,9% с генотипом 3; 4,7% с генотипом 4; 3,7% с коинфекцией ВИЧ; 13,4% с текущим/бывшим внутривенным употреблением наркотиков. Из 5196 пациентов, прошедших оценку эффективности, 98,9% достигли УВО12/24. Высокие показатели УВО12/24 наблюдались при всех генотипах, включая генотип 3 (98,3%; 1649/1677) и у пациентов с компенсированным циррозом (97,9; 1055/1078). Только 55 пациентов не достигли УВО12/24 по вирусологической причине; единственным фактором, статистически значимо связанным с повышенным риском недостижения УВО12/24, был компенсированный цирроз ( P = .002). В целом, 6% (332/5552) пациентов не достигли УВО12/24 по невирусологическим причинам (67% потеряны для последующего наблюдения; 26,5% преждевременно прекратили лечение).
Выводы:
В этой большой когорте, репрезентативной для клинической практики, простая 12-недельная схема лечения SOF/VEL без рибавирина привела к высоким показателям УВО12/24 в различных группах пациентов, даже среди пациентов с компенсированным циррозом.
Ключевой момент.
Возможность достижения излечения более 95% пациентов с ВГС, лечившихся противовирусными препаратами прямого действия, сделала устранение ВГС, приоритет общественного здравоохранения, возможным. Однако для этого необходимо, чтобы схемы лечения были простыми и хорошо переносимыми, а также эффективными, с очень небольшой потребностью в тестировании до или после лечения. В этом большом реальном анализе данных, собранных по всему миру, прием софосбувира/велпатасвира один раз в день вылечил почти 99% пациентов после 12-недельного курса лечения в группе пациентов, которые отражают разнообразие инфицированных ВГС в обычной клинической практике.
1. ВВЕДЕНИЕ
Вирус гепатита С (ВГС) является серьезной медицинской и общественной проблемой здравоохранения во всем мире. 1 Клиническая эффективность, благоприятный профиль безопасности и высокая переносимость пациентами противовирусных препаратов прямого действия (ПППД) хорошо известны, а показатели излечения превышают 95% в эпоху лечения ПППД. 2 Благодаря высоким показателям излечения и связанному с этим снижению трансплантации печени, гепатоцеллюлярной карциномы и смертности 3 , 4 ПППД произвели революцию в лечении ВГС и рекомендованы Всемирной организацией здравоохранения (ВОЗ) для обеспечения излечения более 80% затронутых лиц и достижения элиминации ВГС к 2030 году 1 , 5 Однако, несмотря на доступность этих высокоэффективных схем ПППД, около 71 миллиона человек во всем мире все еще ждут лечения, и только 15 стран в настоящее время находятся на пути к достижению элиминации ВГС к 2030 году. 6
Рекомендуемые схемы DAA могут различаться по продолжительности, частоте дозирования и нагрузке таблеток, а также по необходимости совместного приема с рибавирином. 2 , 7 Выбор терапевтической схемы может также зависеть от генотипа HCV, истории предыдущего лечения и тяжести печеночной недостаточности. Эффективные пангенотипические схемы, которые позволяют упростить лечение HCV в отношении минимального мониторинга, генотипирования и оценки стадии фиброза, были определены как имеющие важное значение для обеспечения того, чтобы элиминация HCV стала реальностью. 8 , 9
Софосбувир/велпатасвир (SOF/VEL) является первым пангенотипическим, панфибротическим, без ингибиторов протеазы, полностью пероральным режимом приема одной таблетки и может использоваться в качестве фиксированной 12-недельной продолжительности лечения у всех взрослых пациентов с хроническим гепатитом С.10 Исследования фазы 3 ASTRAL-1, -2, -3 и -5 установили эффективность и безопасность SOF/VEL у более чем 1100 пациентов с хроническим ВГС и сообщили о показателях устойчивого вирусологического ответа (УВО) 95%-100% у пациентов, инфицированных генотипами ВГС 1-6, с компенсированным циррозом или без него и независимо от статуса вируса иммунодефицита человека (ВИЧ) или предыдущей неудачи лечения интерфероном, рибавирином или ингибиторами протеазы.
Расширение использования DAA в клинической практике в последние годы предоставило возможность оценить их эффективность и безопасность в реальных когортах, за пределами контролируемых условий клинических испытаний. Несколько реальных когорт оценили эффективность и безопасность SOF/VEL в различных условиях, причем результаты были аналогичны результатам клинических испытаний.
В этом комплексном реальном анализе были объединены данные из 12 когорт клинической практики в различных реальных условиях в Канаде, Европе и США, чтобы дать возможность оценить реальную эффективность SOF/VEL в течение 12 недель (препарат Велакаст) без рибавирина (на основе инструкции или по усмотрению врача) в самой большой доступной гетерогенной популяции пациентов с ВГС и изучить любые характеристики пациентов, влияющие на риск недостижения УВО.
2. ПАЦИЕНТЫ И МЕТОДЫ
Этот объединенный анализ включал данные из 12 когорт клинической практики в Канаде, Франции, Германии, Греции, Италии, Испании и США (таблица 1 ). Были включены пациенты, получавшие пероральную терапию по одной таблетке SOF/VEL 400/100 мг один раз в день в течение 12 недель. Пациенты проходили лечение в разных клинических условиях, включая университетские больницы, академические центры, общественные центры, амбулаторные клиники и частные практики. Лечение и мониторинг пациентов основывались на местной клинической практике и стандартах лечения по усмотрению лечащего врача.
| Когорта | Доступные данные | Страна | Детали условий, включенных в каждую когорту |
|---|---|---|---|
| ANRS‐Hepather | Сводные данные | Франция | Многоцентровая проспективная наблюдательная когорта, включающая пациентов, проходящих лечение в 32 экспертных гепатологических центрах |
| Borgia | Данные пациентов | Канада | Когорта из специализированной клиники вирусного гепатита в крупной общественной полуакадемической больнице третичной помощи, оборудованной специализированной медсестрой и FibroScan® |
| DHC‐R | Сводные данные | Германия | Когорта из смешанной среды врачей частной практики (около 80%, включая специалистов по гастроэнтерологии/гепатологии и инфекционным заболеваниям) и университетских амбулаторных клиник |
| Greek Cohort | Данные пациентов | Греция | Когорта из амбулаторных клиник третичного центра печени и одной частной амбулаторной клиники |
| HCV‐TARGET | Данные пациентов | Европа/США | Когорта из 44 академических и 17 общественных центров, предоставляющих медицинскую помощь и противовирусное лечение пациентам с ВГС |
| HepaC | Данные пациентов | Испания | Многоцентровая проспективная наблюдательная когорта реального мира, включающая пациентов, направленных из клиник лечения зависимости |
| HELIOS | Данные пациентов | Франция | Многоцентровая проспективная когорта реального мира, включающая пациентов, проходящих лечение в 46 центрах |
| Mangia | Данные пациентов | Италия | Когорта из частных исследовательских больниц, а также пациентов, направленных из различных учреждений, включая центры лечения зависимости |
| NAVIGATORE‐II | Данные пациентов | Италия | Многоцентровая проспективная когорта реального мира, включающая пациентов, проходящих лечение в нескольких клинических центрах |
| Ramji | Данные пациентов | Канада | Когорта из академического учреждения третичной помощи за пределами больницы |
| Shafran | Данные пациентов | Канада | Когорта из университетской больницы с амбулаторным корпусом через дорогу от больницы. Около 80% пациентов были направлены врачами, остальные обратились самостоятельно |
| TRIO Health | Данные пациентов | США | Когорта медицинских работников и специализированных аптек |
2.2 Сбор данных
Демографические данные и характеристики лечения собирались на исходном уровне. Причины не достижения УВО через 12 или 24 недели после окончания лечения (УВО12/24), раннего прекращения лечения, потери для последующего наблюдения (LTFU) и причины смерти (если применимо) оценивались в соответствии с местными стандартами клинической практики и документировались по усмотрению лечащего врача. Данные на уровне пациентов были доступны для 10 когорт и данные на уровне сводки для оставшихся двух когорт.
2.3 Критерии включения и исключения
Были включены взрослые пациенты, получавшие лечение SOF/VEL 400/100 мг в течение 12 недель с действительным статусом SVR12/24, или пациенты, прекратившие лечение досрочно (до конца февраля 2019 года). Критерии включения включали инфицирование генотипами HCV 1-6 и отсутствие или наличие компенсированного цирроза. Также были включены пациенты, не получавшие лечения или ранее получавшие терапию на основе интерферона (пегилированный интерферон плюс рибавирин с телапревиром, боцепревиром или симепревиром или без них). Из анализа были исключены следующие пациенты: пациенты, получавшие SOF/VEL более 12 недель или получавшие рибавирин в рамках схемы лечения; пациенты с текущим или предшествующим декомпенсированным циррозом или гепатоцеллюлярной карциномой; и пациенты, у которых ранее не проводилась терапия ПППД (включены пациенты, ранее получавшие лечение пегилированным интерфероном плюс рибавирин с боцепревиром, телапревиром или симепревиром или без них).
2.4.Оценка результатов
Эффективность оценивалась в общей популяции, включая всех пациентов с вирусологической, невирусологической и неизвестной причиной не достижения УВО12/24. Эффективность также оценивалась в популяции эффективности, из которой исключались пациенты, у которых не было действительного статуса УВО12/24 по невирусологическим или неизвестным причинам. Невирусологические причины определялись как раннее прекращение лечения, несоблюдение режима лечения, повторное инфицирование, LTFU, смерть до оценки УВО, отзыв согласия. Вирусологические причины определялись как вирусологический прорыв/отсутствие ответа, рецидив или вирусологическая неудача без доступности или дополнительных подробностей. Пациенты без информации о вирусологической или невирусологической причине не достижения УВО12/24 были классифицированы как «неизвестная причина». Первичным результатом был УВО12/24, который рассчитывался в общей популяции и популяции эффективности и стратифицирован по стадии фиброза, предыдущему или текущему употреблению внутривенных наркотиков и истории лечения. Во-вторых, оценивалось влияние характеристик пациента на риск недостижения УВО12/24 по вирусологическим причинам (рецидив, прорыв, отсутствие ответа).
2.5 Статистический анализ
Описательные характеристики были представлены как число (n) и процент пациентов (%) для категориальных переменных. Непрерывные переменные были суммированы как среднее значение (стандартная ошибка; SE). Влияние характеристик пациента — компенсированный цирроз (да против нет), коинфекция ВИЧ/HCV (да против нет), история лечения (наивное лечение против лечения), генотип HCV (генотип 3, выступающий в качестве референтной группы), использование ингибиторов протонной помпы (ИПП) на исходном уровне (да против нет), внутривенное употребление наркотиков (да против нет) — на риск не достижения УВО12/24 из-за вирусологических причин оценивалось с помощью логистической регрессии, учитывающей случайные эффекты когорты. Логистический регрессионный анализ проводился в подгруппе популяции эффективности с доступными данными на уровне пациента и без пропущенных данных для каждой характеристики. Порог значимости был установлен на уровне P < .008 (= 0,05/6) для учета множественного тестирования. Все анализы проводились с использованием R v3.4.3.
3. РЕЗУЛЬТАТЫ
3.1. Схема течения болезни пациента и исходные характеристикиВ этот реальный объединенный анализ (общая популяция пациентов) были включены 5552 пациента, инфицированных вирусом гепатита С, из 12 клинических когорт (таблица 1 ), которые начали лечение с помощью SOF/VEL в течение 12 недель без рибавирина. Пациенты, которые не достигли УВО12/24 по невирусологическим (n = 332) или неизвестным причинам (n = 24), были исключены из популяции эффективности. Блок-схема пациента, включая результат УВО12/24, представлена на рисунке 1. Исходные характеристики пациентов для общей популяции пациентов и для популяции эффективности показаны в таблице 2 .
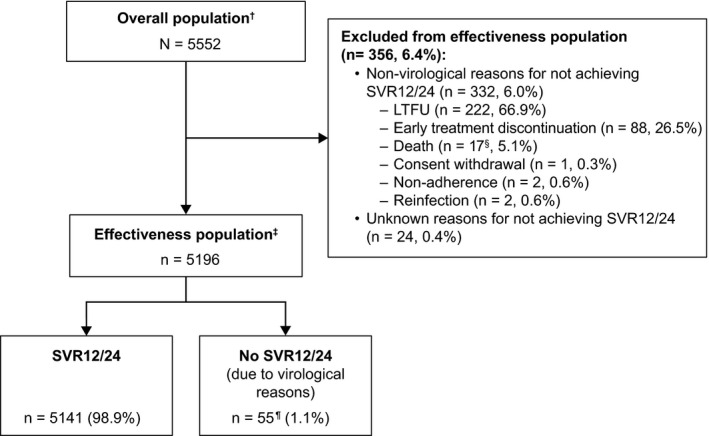
Блок-схема и ответ пациентов, включенных в анализ эффективности в реальных условиях. † Общая популяция включает всех пациентов, достигших УВО12/24, и тех, кто не достиг УВО12/24 по вирусологическим и невирусологическим причинам, и пациентов, у которых причина достижения УВО12/24 неизвестна. ‡ Популяция эффективности включает всех пациентов, достигших УВО12/24, и тех, кто не достиг УВО12/24 по вирусологическим причинам. § Два пациента умерли из-за сепсиса, один из-за рака (не уточняется), один из-за кровохарканья вследствие первичного рака легких, причина смерти не была указана для 13 пациентов. ¶ У 32 пациентов произошел рецидив, 11 не ответили на терапию, у трех были прорывы; подробности вирусологической причины не были указаны для девяти пациентов, как было оценено и задокументировано лечащим врачом. LFTU, потерян для последующего наблюдения; УВО12/24, устойчивый вирусологический ответ через 12/24 недели после окончания лечения
| Характеристики | Общая популяция пациентов (N = 5552) | Популяция эффективности (n = 5196) |
|---|---|---|
| Возраст | ||
| Средний возраст, лет (СО) | 56 (2.6) | 56 (2.8) |
| Неизвестно, n (%) | 11 (0.2) | 209 (4.0) |
| Пол, n (%) | ||
| Мужской | 3225 (58.1) | 2902 (55.9) |
| Женский | 2325 (41.9) | 2013 (38.7) |
| Неизвестно | 2 (0.04) | 281 (5.4) |
| Этническая принадлежность, n (%) | ||
| Европеоидная/Белая | 3683 (66.3) | 3523 (67.8) |
| Азиатская | 108 (1.9) | 100 (1.9) |
| Чернокожие/Африканцы | 155 (2.8) | 136 (2.6) |
| Испаноязычные/Латиноамериканцы | 59 (1.1) | 52 (1.0) |
| Другое | 54 (1.0) | 48 (0.9) |
| Неизвестно | 1493 (26.9) | 1337 (25.7) |
| ВИЧ-коинфекция, n (%) | ||
| Да | 204 (3.7) | 186 (3.6) |
| Нет | 5101 (91.9) | 4766 (91.7) |
| Неизвестно | 247 (4.4) | 244 (4.7) |
| Внутривенное употребление наркотиков, n (%) | ||
| Бывшее или текущее употребление | 743 (13.4) | 689 (13.3) |
| Нет употребления в прошлом или настоящем | 2058 (37.1) | 1992 (38.3) |
| Неизвестно | 2751 (49.6) | 2515 (48.4) |
| Стадия фиброза, n (%) | ||
| F0‐F2 | 2984 (53.7) | 2839 (54.6) |
| F3 | 737 (13.3) | 704 (13.6) |
| F4 (цирроз) | 1147 (20.7) | 1078 (20.7) |
| Нет цирроза, стадия фиброза неизвестна | 596 (10.7) | 493 (9.5) |
| Стадия фиброза неизвестна | 88 (1.6) | 82 (1.6) |
| ИПП (Ингибиторы протонной помпы), n (%) | ||
| Использование ИПП на исходном уровне | 515 (9.3) | 478 (9.2) |
| Нет использования ИПП на исходном уровне | 3130 (56.4) | 2848 (54.8) |
| Неизвестно использование ИПП на исходном уровне | 1907 (34.3) | 1870 (36.0) |
| История лечения, n (%) | ||
| Ранее не получавшие лечения | 4815 (86.7) | 4521 (87.0) |
| История лечения неизвестна | 39 (0.7) | 33 (0.6) |
| Ранее получавшие лечение (ПППД-наивные) | 698 (12.6) | 642 (12.4) |
| ПЭГ-ИФН + рибавирин | 484 (69.3) | 452 (70.4) |
| ПЭГ-ИФН + рибавирин + ИП | 16 (2.3) | 15 (2.3) |
| Множественные предыдущие лечения | 3 (0.4) | 3 (0.5) |
| Предыдущее лечение не указано | 195 (27.9) | 172 (26.8) |
| Генотип ВГС, n (%) | ||
| ГТ 1 | 1695 (30.5) | 1613 (31.0) |
| ГТ 1a | 495 (29.2) | 472 (29.3) |
| ГТ 1b | 350 (20.6) | 329 (20.4) |
| ГТ 1 смешанный подтип | 2 (0.1) | 2 (0.1) |
| ГТ 1 неизвестный подтип | 848 (50.0) | 810 (50.2) |
| ГТ 2 | 1637 (29.5) | 1546 (29.8) |
| ГТ 3 | 1825 (32.9) | 1677 (32.3) |
| ГТ 4 | 259 (4.7) | 239 (4.6) |
| ГТ 5-6 | 76 (1.4) | 68 (1.3) |
| Смешанный ГТ | 11 (0.2) | 11 (0.2) |
| Неизвестный ГТ | 49 (0.9) | 42 (0.8) |
Сокращения: DAA — противовирусный препарат прямого действия; F — фиброз; GT — генотип; PEG-IFN — пегилированный интерферон; PI — ингибитор протеазы; PPI — ингибитор протонной помпы; SE — стандартная ошибка; SOF/VEL — софосбувир/велпатасвир. аДля одной когорты был указан только средний возраст и процент пациентов мужского пола, и только для общей когорты, а не для популяции эффективности этой когорты. Это приводит к тому, что число неизвестных выше в популяции эффективности, чем в общей популяции. бДругое: этническая принадлежность не указана (n = 44), коренной житель (n = 4), гавайец или житель других островов Тихого океана (n = 3), американский индеец или уроженец Аляски (n = 2), египтянин (n = 1), по указанию лечащего врача. сОпределение бывшего употребления наркотиков различалось между когортами с точки зрения сроков, и этот уровень детализации был недоступен для большинства пациентов. гСтепень фиброза определялась лечащим врачом в соответствии с местными стандартами оказания медицинской помощи. еИнформация о продолжении лечения ИПП во время лечения СОФ/ВЭЛ, а также о дозе или типе ИПП отсутствует. фПациенты, у которых документально подтверждено, что они получили по крайней мере один курс ПЕГ-ИФН + рибавирин и один курс ПЕГ-ИФН + рибавирин + ИП.
3.2 Эффективность SOF/VEL в течение 12 недель без рибавирина
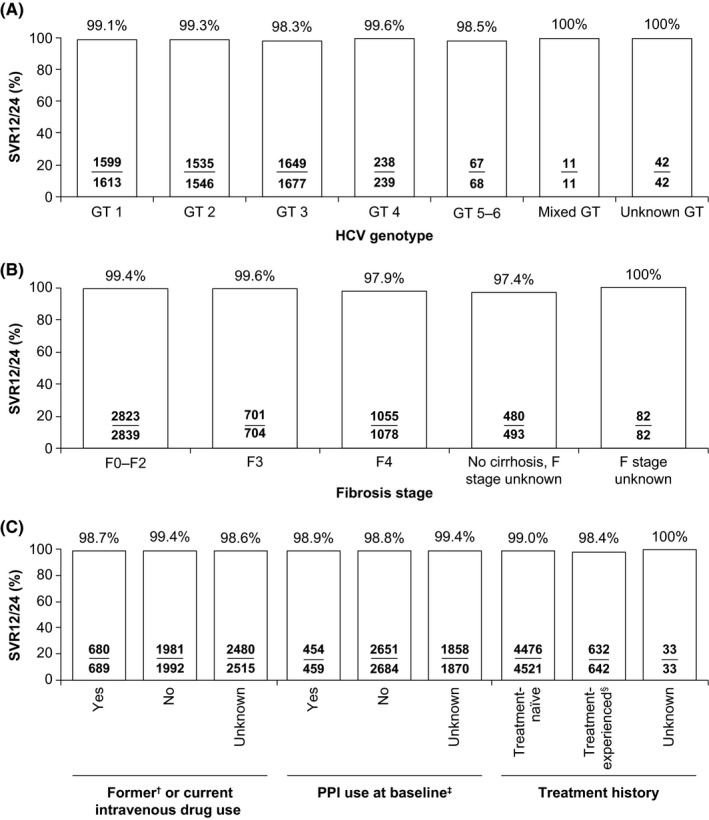
Особенности лечения гепатита С при циррозе. УВО12/24 в анализе популяции эффективности. Процент пациентов, достигших УВО12/24 в популяции эффективности после лечения с помощью SOF/VEL в течение 12 недель без рибавирина, стратифицированный по (A) генотипу HCV (B) стадии фиброза (C) внутривенному употреблению наркотиков, использованию ИПП на исходном уровне и истории лечения. † Определение предыдущего употребления наркотиков различалось между когортами в отношении сроков, и этот уровень детализации был недоступен для большинства пациентов. ‡ Информация о пациентах, достигших УВО12/24 путем использования ИПП на исходном уровне, не была доступна в одной когорте, и, таким образом, пациенты из этой когорты (n = 183) не учитывались в этом анализе подгруппы. § Пациенты получали лечение с помощью PEG-IFN + RBV (± ИП боцепревир, телапревир, симепревир). F, фиброз; GT, генотип; PEG-IFN, пегилированный интерферон; PI, ингибитор протеазы; PPI, ингибитор протонной помпы; RBV, рибавирин; SOF/VEL, софосбувир/велпатасвир; SVR12/24, устойчивый вирусологический ответ через 12/24 недели после окончания лечения
В популяции эффективности УВО12/24 был достигнут 98,9% пациентов (5141/5196) (Рисунок 1 ), при этом УВО12/24 составил ≥98,3% при стратификации по генотипу (Рисунок 2A ). Дальнейшие анализы подгрупп продемонстрировали показатели УВО12/24 ≥97,4% при стратификации по стадии фиброза (Рисунок 2B ). При стратификации по внутривенному употреблению наркотиков, истории лечения и использованию ИПП УВО12/24 ≥ 98,4% был достигнут во всех подгруппах (Рисунок 2C ).
Показатели УВО12/24 в зависимости от подтипа у пациентов с генотипом 1 вируса гепатита С составили: 98,7% (466/472) для генотипа 1a, 98,8% (325/329) для генотипа 1b, 100% (2/2) для генотипа 1 со смешанным подтипом и 99,5% (806/810) при генотипе 1 с неизвестным подтипом.
Данные об эффективности SOF/VEL, стратифицированные по генотипу и наличию компенсированного цирроза, были доступны для 4734 пациентов из десяти когорт. Показатели УВО12/24 у этих пациентов с компенсированным циррозом составили: 98,3% (349/355) для генотипа 1, 98,5% (266/270) для генотипа 2, 96,9% (314/324) для генотипа 3, 100% (38/38) для генотипа 4, 100% (13/13) для генотипа 5 и 100% (5/5) для смешанного/неизвестного генотипа.
3.3 Общие показатели излечения и причины не достижения УВО12/24 при использовании SOF/VEL в течение 12 недель
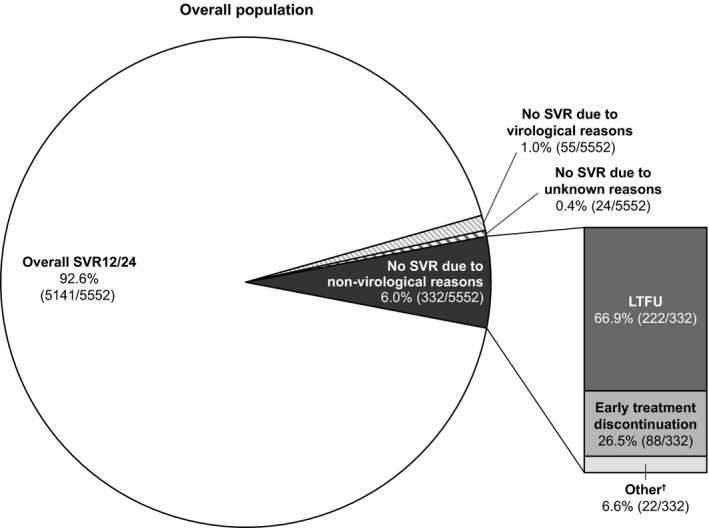
Результаты SVR12/24 в общей популяции пациентов. Результаты лечения в общей популяции пациентов, получавших лечение с помощью SOF/VEL в течение 12 недель без RBV. † Другие невирусологические причины: смерть (5,1%; 17/332), отзыв согласия (0,3%; 1/552), несоблюдение режима лечения (0,6%; 2/332) и повторное инфицирование (0,6%; 2/332). LFTU, потерян для последующего наблюдения; RBV, рибавирин; SOF/VEL, софосбувир/велпатасвир; SVR12/24, устойчивый вирусологический ответ через 12/24 недели после окончания лечения
| Характеристики | По вирусологическим причинам (n = 55) | По невирусологическим причинам | Причина неизвестна (n = 24) | ||
|---|---|---|---|---|---|
| Всего (n = 332) | Потеря для наблюдения (n = 222) | Раннее прекращение (n = 88) | |||
| Возраст | |||||
| Средний возраст, лет (СО) | 56 (2.1) | 52 (2.7) | 49 (1.9) | 54 (4.3) | 51 (10.5) |
| Пол, n (%) | |||||
| Мужской | 35 (63.6) | 177 (53.3) | 95 (42.8) | 46 (52.3) | 15 (62.5) |
| Женский | 12 (21.8) | 102 (30.7) | 55 (24.8) | 35 (39.8) | 9 (37.5) |
| Неизвестно | 8 (14.5) | 53 (16.0) | 72 (32.4) | 7 (8.0) | 0 |
| Этническая принадлежность, n (%) | |||||
| Европеоидная/Белая | 25 (45.5) | 141 (42.5) | 87 (39.2) | 47 (53.4) | 19 (79.2) |
| Азиатская | 2 (3.6) | 8 (2.4) | 4 (1.8) | 4 (4.5) | 0 |
| Чернокожие/Африканцы | 3 (5.5) | 17 (5.1) | 14 (6.3) | 0 | 2 (8.3) |
| Испаноязычные/Латиноамериканцы | 1 (1.8) | 7 (2.1) | 4 (1.8) | 2 (2.3) | 0 |
| Другое | 0 | 6 (1.8) | 5 (2.3) | 0 | 0 |
| Неизвестно | 24 (43.6) | 153 (46.1) | 108 (48.6) | 35 (39.8) | 3 (12.5) |
| ВИЧ-коинфекция, n (%) | |||||
| Да | 5 (9.1) | 17 (5.1) | 8 (3.6) | 5 (5.7) | 1 (4.2) |
| Нет | 50 (90.9) | 312 (94.0) | 211 (95.0) | 83 (94.3) | 23 (95.8) |
| Неизвестно | 0 | 3 (0.9) | 3 (1.4) | 0 | 0 |
| Внутривенное употребление наркотиков, n (%) | |||||
| Бывшее или текущее употребление | 9 (16.4) | 48 (14.5) | 22 (9.9) | 7 (8.0) | 6 (25.0) |
| Нет употребления в прошлом или настоящем | 11 (20.0) | 65 (19.6) | 21 (9.5) | 7 (8.0) | 1 (4.2) |
| Неизвестно | 35 (63.6) | 219 (66.0) | 179 (80.6) | 74 (84.1) | 17 (70.8) |
| Стадия фиброза, n (%) | |||||
| F0-F2 | 16 (29.1) | 130 (39.2) | 52 (23.4) | 32 (36.4) | 15 (62.5) |
| F3 | 3 (5.5) | 27 (8.1) | 14 (6.3) | 8 (9.1) | 6 (25.0) |
| F4 (цирроз) | 13 (23.6) | 103 (31.0) | 75 (33.8) | 25 (28.4) | 0 |
| Нет цирроза, стадия фиброза неизвестна | 23 (41.8) | 66 (19.9) | 29 (13.1) | 22 (25.0) | 3 (12.5) |
| Стадия фиброза неизвестна | 0 | 6 (1.8) | 52 (23.4) | 1 (1.1) | 0 |
| ИПП, n (%) | |||||
| Использование ИПП на исходном уровне | 5 (9.1) | 59 (17.8) | 15 (6.8) | 14 (15.9) | 0 |
| Нет использования ИПП на исходном уровне | 33 (60.0) | 249 (75.0) | 115 (51.8) | 67 (76.1) | 11 (45.8) |
| Неизвестно использование ИПП на исходном уровне | 17 (30.9) | 24 (7.2) | 92 (41.4) | 7 (8.0) | 13 (54.2) |
| История лечения, n (%) | |||||
| Ранее не получавшие лечения | 45 (81.8) | 274 (82.5) | 141 (63.5) | 81 (92.0) | 20 (83.3) |
| История лечения неизвестна | 0 | 6 (1.8) | 56 (25.2) | 1 (1.1) | 0 |
| Ранее получавшие лечение (ПППД-наивные) | 10 (18.2) | 52 (15.7) | 25 (11.3) | 6 (6.8) | 4 (16.7) |
| Генотип ВГС, n (%) | |||||
| ГТ 1 | 14 (25.5) | 76 (22.9) | 27 (12.2) | 27 (30.7) | 6 (25.0) |
| ГТ 2 | 11 (20.0) | 84 (25.3) | 48 (21.6) | 23 (26.1) | 7 (29.2) |
| ГТ 3 | 28 (50.9) | 137 (41.3) | 85 (38.3) | 32 (36.4) | 11 (45.8) |
| ГТ 4 | 1 (1.8) | 20 (6.0) | 5 (2.3) | 2 (2.3) | 0 |
| ГТ 5-6 | 1 (1.8) | 8 (2.4) | 2 (0.9) | 2 (2.3) | 0 |
| Смешанный генотип | 0 | 0 | 0 | 0 | 0 |
| Генотип неизвестен | 0 | 7 (2.1) | 55 (24.8) | 2 (2.3) | 0 |
Сокращения: ПППД — противовирусные препараты прямого действия; ГТ — генотип; ПЕГ-ИФН — пегилированный интерферон; ИПП — ингибитор протонной помпы; РБВ — рибавирин; СОФ/ВЭЛ — софосбувир/велпатасвир; УВО12/24 — устойчивый вирусологический ответ через 12/24 недели после окончания лечения. аДругие невирусологические неудачи включали смерть (n = 17, 4,8%), отзыв согласия (n = 1, 0,3%), несоблюдение режима лечения (n = 2, 0,6%) и повторное инфицирование (n = 2, 0,6%). бОпределение бывшего употребления наркотиков различалось между когортами с точки зрения сроков, и этот уровень детализации был недоступен для большинства пациентов. сСтепень фиброза определяется лечащим врачом. гИнформация о продолжении или прекращении лечения ИПП во время лечения СОФ/ВЭЛ отсутствует. еПациенты получали лечение с помощью ПЭГ-ИФН + РБВ (± ИП боцепревир, телапревир, симепревир).
В общей популяции пациентов УВО12/24 составил 92,6%, и только 411 пациентов (7,4%) не достигли УВО12/24: 6,0% (332/5552) по невирусологическим причинам и 1,0% (55/5552) по вирусологическим причинам (Рисунок 3 ). Причина недостижения УВО12/24 была неизвестна у 0,4% (24/5552) пациентов. Исходные характеристики пациентов, не достигших УВО12/24, приведены в Таблице 3 .
3.4 Пациенты, не достигшие УВО12/24 по невирусологическим причинам
Основными невирусологическими причинами не достижения УВО12/24 были LTFU (66,9%; 222/332) и раннее прекращение лечения (26,5%; 88/332). Из 222 пациентов, у которых был LTFU, время, когда это произошло, было доступно для 67,6% пациентов (150/222): 40% (60/150) были LTFU во время лечения и 60% (90/150) между окончанием лечения и 12 или 24 неделей после лечения.
Причины досрочного прекращения лечения были известны у 17% (15/88) пациентов: трое прекратили лечение, поскольку им отказали в страховке или они не могли позволить себе лечение; один переехал в другую страну; трое не соблюдали режим лечения; и восемь прекратили лечение из-за побочных эффектов (не указанных отдельно) или страха побочных эффектов.
3.5 Пациенты, не достигшие УВО12/24 по вирусологическим причинам
| Характеристики | Нет УВО/УВО12/24 (%) | Отношение шансов | 95% ДИ | P |
|---|---|---|---|---|
| Генотип ВГС | ||||
| ГТ 3 | 22/1518 (1.4) | Реф. | — | — |
| ГТ 1 | 12/1444 (0.8) | 0.84 | 0.39‐1.70 | .634 |
| ГТ 2 | 11/1434 (0.8) | 0.66 | 0.30‐1.38 | .285 |
| ГТ 4 | 1/193 (0.5) | 0.61 | 0.03‐3.01 | .629 |
| ГТ 5-6 | 1/50 (2.0) | 0.86 | 0.05‐4.41 | .881 |
| Компенсированный цирроз | ||||
| Нет | 27/3640 (0.7) | Реф. | — | — |
| Да | 20/985 (2.0) | 2.53 | 1.38‐4.55 | .002 |
| Внутривенное употребление наркотиков | ||||
| Нет | 8/1666 (0.5) | Реф. | — | — |
| Да | 4/541 (0.7) | 1.35 | 0.34‐4.49 | .642 |
| Использование ИПП на исходном уровне | ||||
| Нет | 30/2389 (1.3) | Реф. | — | — |
| Да | 5/445 (1.1) | 1.08 | 0.36‐2.62 | .870 |
| История лечения | ||||
| Ранее не получавшие лечения | 39/4124 (0.9) | Реф. | — | — |
| Ранее получавшие лечение | 8/530 (1.5) | 1.28 | 0.54‐2.66 | .543 |
| ВИЧ/ВГС коинфекция | ||||
| Нет | 43/4267 (1.0) | Реф. | — | — |
| Да | 4/176 (2.3) | 2.71 | 0.78‐7.26 | .072 |
Сокращения: 95% ДИ — 95% доверительный интервал; ГТ — генотип; ИПП — ингибитор протонной помпы; Ср. — референтная группа; УВО12/24 — устойчивый вирусологический ответ через 12/24 недели после окончания лечения. Логистический регрессионный анализ, скорректированный с учетом случайных эффектов когорты, был выполнен в объединенной подгруппе популяции эффективности с доступными данными на индивидуальном уровне и без пропущенных данных по каждой характеристике. аТекущее или прошлое внутривенное употребление наркотиков. Определение бывшего употребления наркотиков различалось между когортами в отношении времени, и этот уровень детализации был недоступен для большинства пациентов.
В общей популяции пациентов 1,0% (55/5552) пациентов не достигли УВО12/24 по вирусологической причине (Рисунок 3 ). Информация о повторном лечении была доступна для 23 пациентов. Из них 83% (19/23) пациентов прошли повторное лечение; 89% (17/19) успешно. Из четырех пациентов, которые не прошли повторное лечение, у трех была диагностирована гепатоцеллюлярная карцинома, и один умер до начала повторного лечения (причина смерти не была указана). Использовались следующие схемы лечения: софосбувир/велпатасвир/воксилапревир (SOF/VEL/VOX; 17/19), SOF/VEL/VOX плюс рибавирин (1/19) и глекапревир/пибрентасвир плюс софосбувир (1/19).
Логистический регрессионный анализ был проведен в объединенной подгруппе пациентов из популяции эффективности с доступными данными на индивидуальном уровне, чтобы изучить влияние характеристик пациента на не достижение УВО12/24 по вирусологическим причинам. Генотип, внутривенное употребление наркотиков, использование ИПП на исходном уровне, история лечения и коинфекция ВИЧ/ВГС не были значимо связаны с риском не достижения УВО12/24 после контроля случайных эффектов когорты ( P > .05; Таблица 4 ). Только компенсированный цирроз был связан с повышенным риском не достижения УВО12/24 по вирусологическим причинам (OR = 2.53, 95% ДИ 1.38-4.55, P = .002; Таблица 4 ). Среди пациентов с компенсированным циррозом, включенных в этот анализ, 2% (20/985) не достигли УВО12/24; 0,7% (27/3640) пациентов без компенсированного цирроза не достигли УВО12/24.
4. ОБСУЖДЕНИЕ
В этом объединенном анализе когорт реальной клинической практики более 5000 пациентов с инфекцией ВГС завершили лечение с помощью SOF/VEL (Велакаст) в течение 12 недель и достигли показателя SVR12/24 98,9%, что соответствует результатам предыдущих клинических испытаний. 11 , 12 Это самая большая реальная когорта пациентов, получавших лечение с помощью ПППД на сегодняшний день, что позволило проанализировать эффективность в нескольких подгруппах пациентов. Показатели SVR12/24 были высокими, несмотря на включение различных типов пациентов из разных географических регионов, лечившихся в разных клинических условиях с использованием различных протоколов ведения для мониторинга и тестирования до и во время лечения. Низкие показатели прекращения лечения (менее2%) и LTFU (4%) в этом реальном анализе согласуются с предыдущими клиническими исследованиями. 11 , 12 Кроме того, при наличии информации лишь немногие из прекращений лечения были вызваны нежелательными явлениями, связанными с терапией SOF/VEL, что соответствует данным фазы 3. Это подчеркивает благоприятный профиль безопасности и переносимости SOF/VEL как ПППД без ингибиторов протеазы, как также было показано ранее в клинических испытаниях. Частота вирусологических неудач была очень низкой и составила 1,0% (55/5552) и была близка к частоте 1,2% (20/1690), наблюдаемой в комбинированных клинических испытаниях ASTRAL-1,2,3,5 и POLARIS-2,3 фазы 3. 11 , 12 , 14 , 25
Показатели УВО12/24 в полном анализе 12 когорт составили 96,9% или выше и были аналогичны ранее зарегистрированным показателям излечения среди различных групп пациентов, включая пациентов, не получавших лечения, пациентов с компенсированным циррозом и пациентов с текущим или бывшим употреблением наркотиков. 11 , 12 , 26 , 27 , 28 Высокие показатели УВО12/24 были достигнуты среди всех генотипов, включая генотип 3, который не был связан с более высоким риском недостижения УВО12/24 по вирусологическим причинам. Следует отметить, что эта когорта включает наибольшее количество пациентов, инфицированных генотипом 3, зарегистрированных на сегодняшний день в реальном анализе данных. Из 1677 пациентов с инфекцией генотипа 3 98,3% были излечены без рибавирина. Эти результаты соответствуют результатам исследований фазы 3 ASTRAL-3 и POLARIS-3, в которых сообщалось о показателях УВО12 от 93% до 98% у пациентов без цирроза и с циррозом.
Поскольку основное внимание в лечении ВГС уделяется его элиминации, необходимость упрощения лечения и ведения пациентов (со снижением необходимости в предварительном и во время лечения тестировании) считается ключевым шагом в достижении целей ВОЗ, поскольку позволяет сократить время между диагностикой ВГС и началом лечения, тем самым поощряя подход «тестируй и лечи». 8 , 29 , 30 Это также подтверждается в призыве к действию по работе над элиминацией вируса гепатита С, запущенном Американской ассоциацией по изучению заболеваний печени (AASLD) / Европейской ассоциацией по изучению печени (EASL) / Азиатско-Тихоокеанской ассоциацией по изучению печени / Латиноамериканской ассоциацией по изучению печени и представленном на встрече AASLD по заболеваниям печени в ноябре 2019 года. 31 Все пациенты с неизвестным генотипом, неизвестным показателем фиброза и неизвестной историей лечения в этой большой когорте пациентов были излечены с помощью SOF/VEL в течение 12 недель, что дает возможность использовать этот режим в упрощенных протоколах лечения без необходимости обширного мониторинга до или во время лечения.
Достижение высоких показателей излечения в этих реальных условиях без добавления рибавирина подтверждает, что рибавирин может не быть необходимым для лечения ВГС в группах населения, где врачи ранее могли рассматривать возможность его использования, включая пациентов с генотипом 3 и с компенсированным циррозом. 2 , 32 , 33 Использование режима без рибавирина также способствует упрощению лечения за счет снижения необходимости мониторинга побочных эффектов, связанных с рибавирином.
Большой размер этой реальной когорты позволил оценить один из немногих оставшихся вопросов в клиническом ведении пациентов с ВГС: существуют ли какие-либо факторы, которые предсказывают риск недостижения УВО? Из 5552 пациентов, получавших лечение с помощью SOF/VEL, только 1% не достигли УВО12/24 из-за известных вирусологических причин. В этой небольшой подгруппе пациентов только наличие компенсированного цирроза было значимо связано с недостижением УВО12/24 из-за вирусологической причины. Другие факторы, включая генотип 3, не были значимо связаны с недостижением УВО12/24. Небольшие числовые различия часто статистически незначимы в небольших исследованиях. Напротив, в этом реальном анализе разница в 1,3% была статистически значимой из-за размера когорты. Однако, поскольку высокие показатели ответа были достигнуты как у пациентов без цирроза (99,2%), так и у пациентов с компенсированным циррозом (97,9%), эта статистически значимая разница вряд ли будет иметь клиническое значение, особенно если учесть, что у большинства людей с инфекцией HCV нет цирроза. Данные о повторном лечении были доступны в подгруппе из 19 пациентов, которые не достигли SVR12/24 с SOF/VEL из-за вирусологических причин; 89% ответили на последующую терапию. Большинство пациентов получали SOF/VEL/VOX в течение 12 недель, что соответствует текущим рекомендациям по лечению.
В дополнение к небольшому числу пациентов, не достигших УВО12/24 по вирусологическим причинам, только 6,7% пациентов не достигли УВО12/24 по невирусологическим причинам, что согласуется с ранее опубликованными данными в нынешнюю эпоху ПППД. 34 , 35 Большинство этих пациентов были LTFU (67%, 222/332). Вполне вероятно, что многие из этих пациентов были излечены, но нет возможности подтвердить это. Этот результат поощряет возможность внедрения широких стратегий элиминации ВГС; однако он также подчеркивает, что все еще есть возможности для дальнейшего улучшения всех этапов каскада лечения. Упрощение и децентрализация лечения ВГС путем разделения задач и интеграции лечения ВГС за пределами специализированных учреждений31 доказали свою эффективность в повышении скрининга и привязки к лечению, а также в улучшении каскада лечения.
Несмотря на большой размер этой реальной когорты пациентов, можно было бы выделить несколько ограничений. Во-первых, неизбежное количество отсутствующих данных из-за различий в правилах и протоколах клинической практики в когортах, отчасти из-за ретроспективного сбора данных. Однако высокие показатели УВО12/24 были продемонстрированы во всех подгруппах пациентов, даже у тех, у кого отсутствовали значения таких характеристик, как статус цирроза, подтип генотипа, история лечения и внутривенное употребление наркотиков, что минимизировало влияние этих отсутствующих данных. Хотя не было единообразных деталей для всех пациентов, таких как методология оценки фиброза, надежная клиническая экспертиза позволила эффективно стадировать пациентов. Также важно признать отсутствие данных о вирусологических результатах у пациентов, которые были LTFU или прекратили лечение на ранней стадии, но это похоже на ситуацию, наблюдаемую в клинических исследованиях. Во-вторых, еще одним ограничением этого исследования была невозможность оценить УВО в когортах с декомпенсированным циррозом, поскольку рекомендации по стандартному лечению предполагают использование рибавирина, что не было целью этого исследования. Кроме того, не все когорты объединяли единообразно собранные поддающиеся оценке данные в этих условиях. Тем не менее, мы смогли показать почти универсальные показатели ответа у пациентов с прогрессирующим, но компенсированным заболеванием печени. Кроме того, поскольку были включены только пациенты, получавшие лечение с помощью SOF/VEL в течение 12 недель без рибавирина, смещение отбора пациентов можно считать ограничением этого анализа. Однако демографические данные пациентов показывают разнообразную популяцию пациентов, с включением пациентов, традиционно считающихся «трудно поддающимися лечению» или «трудноизлечимыми», что демонстрирует ограниченное смещение отбора.
Подводя итог, можно сказать, что эта большая, многоцентровая, реальная, разнообразная когорта клинической практики подчеркивает силу SOF/VEL как простой и эффективной пангенотипической, панфибротической схемы прямого действия, которая требует лишь минимального мониторинга и может применяться в подходе «тестируй и лечи» для достижения цели элиминации вируса гепатита С.
3.6. Европейско-американские пациенты по сравнению с пациентами из Азии
Объединенные данные двух исследований показали, что по сравнению с азиатской группой лечение рибавирином, содержащим рибавирин, достигло более высоких показателей УВО12 у евроамериканских пациентов (ОР = 2,89, 95% ДИ [1,30, 6,40], I2 = 0 % P = 0,009, 381 пациент). С другой стороны, одно исследование показало, что лечение, содержащее рибавирин, не улучшило терапевтический эффект группы рибавирина. В данном анализе была принята модель с фиксированным эффектом.
3.7. Цирротические и нецирротические пациенты
Объединение данных трех исследований (283 пациента без цирроза печени и 141 пациент с циррозом печени) показало, что лечение инфекции HCV GT 1 комбинацией софосбувира и велпатасвира позволило достичь уровня УВО12 97,5% (95% ДИ [95–100%],) у пациентов с циррозом печени и 98,5% (95% ДИ [97–99,9%]) у пациентов без цирроза печени.
4. Дискуссия
Выдающаяся эффективность противовирусных препаратов прямого действия (DAA) делает противовирусное лечение более перспективным. Терапевтический эффект софосбувира при хроническом ВГС был значительно улучшен по сравнению с традиционным режимом лечения, который является хорошим выбором для пациентов с непереносимостью интерферона или лекарственно-устойчивыми к интерферону. Это метаанализовое исследование показывает, что режим приема одной таблетки софосбувир-велпатасвира (Велакаст) высокоэффективен у пациентов с хроническим гепатитом С (GT-6) с уровнем УВО12 >94%. Раньше стандартным противовирусным лечением хронического гепатита С в Китае и многих других странах был интерферон в сочетании с рибавирином. У этого режима есть некоторые недостатки, в том числе низкий уровень устойчивого вирусологического ответа (около 60%), низкий уровень излечения, частые побочные реакции, неудобное введение, плохая приверженность пациентов, длительный курс лечения (обычно 48 недель) и так далее. Появление однотаблеточного режима софосбувир-велпатасвир изменило терапевтический эффект хронического ВГС. Хотя другой аналогичный метаанализ, проведенный Хуссиеном Ахмедом и др., продемонстрировал, что комбинация софосбувира и велпатасвира обеспечивает уровень УВО12 >97%, за исключением пациентов с хроническим гепатитом С (GT 3). Однако между этими двумя метаанализами есть некоторые различия. Во-первых, в одном первичном клиническом исследовании, включенном в исследование Ахмеда, давались софосбувир и 100 мг велпатасвира соответственно. Это не была настоящая схема лечения софосбувиром-велпатасвиром, состоящая из одной таблетки. Следовательно, наше исследование может быть более подходящей оценкой Epclusa. Во-вторых, все выбранные клинические исследования в текущем метаанализе были опубликованы в период с 2015 по 2018 год. Тогда как первичные клинические исследования в исследовании Ахмеда были опубликованы в 2015 году. Напротив, наше исследование более обновлено. Наконец, наше исследование показывает, что добавление рибавирина не увеличивает УВО12 и частоту серьезных нежелательных явлений. Более того, что касается распространенных побочных эффектов при применении софосбувира-велпатасвира у пациентов с ВГС, головная боль возникает чаще.
Софосбувир — это своего рода аналог нуклеозида, который был одобрен в 2013 году. Основные преимущества софосбувира, включая высокий уровень УВО (90%) у пациентов с инфекцией ВГС1, согласуются с результатами этого анализа. Что касается УВО12, анализ подгрупп показывает, что различия между софосбувиром-велпатасвиром и софосбувиром-велпатасвиром плюс рибавирином незначительны, за исключением GT 3. Этот результат предполагает, что добавление рибавирина к софосбувиру-велпатасвиру не имеет дополнительной очевидной клинической пользы. Однако анализ другой подгруппы по показателям вирусологической неудачи показал, что в группе, принимавшей рибавирин, частота вирусологических неудач, таких как прорыв или рецидив, была ниже. Таким образом, ПППД можно использовать с рибавирином, который, как ожидается, уменьшит частоту рецидивов или у пациентов с рецидивом ВГС. Например, в последние годы Руководство по ВГС 2018, составленное Американской ассоциацией по изучению заболеваний печени и Обществом инфекционных заболеваний Америки (AASLD-IDSA), рекомендует ПППД на основе софосбувира в сочетании с рибавирином для пациентов с рецидивом ВГС после трансплантации печени. Во-вторых, был проведен еще один анализ подгрупп, который предполагает, что представители разных национальностей могут получать разные терапевтические эффекты. Всем пациентам с генотипом 3, страдающим циррозом печени или имеющим опыт лечения исходными заменами Y93, Американская ассоциация по изучению заболеваний печени (AASLD) и Американское общество инфекционных заболеваний (IDSA) рекомендуют добавлять рибавирин к софосбувиру и велпатасвиру. В США и Европейском Союзе (ЕС) одна таблетка софосбувира и велпатасвира недавно была одобрена для лечения всех генотипов ВГС у пациентов с нециррозом и компенсированным циррозом (класс А по Чайлд-Пью) или в сочетании с другими генотипами ВГС. с рибавирином для лечения всех генотипов ВГС у пациентов с декомпенсированным циррозом печени. Необходимо разработать дальнейшие исследования для изучения эффекта добавления рибавирина к этому режиму у пациентов с ВГС GT 3 или пациентов из Азии с ВГС.
С точки зрения безопасности частота тяжелых нежелательных явлений не была сопоставима в группах, принимавших рибавирин и не принимавших рибавирин. Тем не менее, согласно выбранным исследованиям в этом метаанализе, общие побочные эффекты при применении софосбувира и велпатасвира многочисленны, и наиболее часто возникают головная боль, утомляемость, тошнота, а также назофарингит.
5. Вывод
Результаты текущего исследования показали, что режим приема одной таблетки софосбувир-велпатасвир является высокоэффективным лечением пациентов с ВГС с GT 1–6. Терапия, содержащая рибавирин, не была связана с очевидным улучшением SVR12 в GT3. Терапия, содержащая рибавирин, также не показала превосходных эффектов у азиатской популяции.
6. Ограничения
Есть несколько ограничений текущего исследования. Во-первых, большинство включенных исследований были открытыми и проводились исключительно в странах Европы и Америки. Кроме того, в некоторые из включенных испытаний входило только одно или два ГТ ВГС. В совокупности следует учитывать риск распределения, эффективности и систематической ошибки в оценке, хотя значимой связи между методологическим качеством и результатами исследования обнаружено не было. Во-вторых, текущее исследование не включало в себя соответствующий контроль и повторение. Кроме того, размер выборки невелик. Поэтому необходимо проводить дальнейшие исследования при строгом контроле и увеличении размера выборки. Наконец, из-за отсутствия данных мы не смогли оценить эффективность комбинации велпатасвира у нескольких пациентов, трудно поддающихся лечению, таких как пациенты с декомпенсированным циррозом печени, резистентными заменами и коинфекцией ВИЧ. Что еще предстоит выяснить.
